Урок на тему «Метаболизм клетки. Пластический обмен в клетке»
Задачи:
I. Образовательные:
- обобщить знание учащихся о строении, химическом составе клетки, закрепить знание и умение по решению задач по молекулярной биологии;
- продолжить формирование понятия о метаболизме клетки;
- систематизировать, обобщить знание о биосинтезе белка и фотосинтезе в клетке как о наиболее важных процессах в метаболизме клетки;
- расширить знания о значении этих процессов.
II. Воспитательные:
- воспитывать бережное отношение к природе, осознать роль зеленых растений в жизни на Земле;
- воспитывать сознательное отношение к здоровому образу жизни, вникнуть в самую сущность жизни человека.
III. Развивающие:
- развитие познавательного интереса к теме;
- развитие интеллектуальных способностей обучаемых;
- развитие предметных и общеучебных умений и навыков;
- развитие навыков самообразования.

Оборудование: Таблицы, мультимедиа динамическое пособие “Биосинтез белка”, раздаточный материал – задачи.
Ход урока
I. Объявление темы урока учителем.
II. Целевая установка учителя.
III. Повторение строения клетки. (устное выполнение теста № 1).
Тест № 1. Исходя из определений впишите соответствующие термины.
- Синтез белков происходит на …
- Система мембран, разделяющих клетку на отдельные отсеки, в которых протекают реакции обмена веществ, называется…
- Внутренние мембранные структуры хлоропластов называются …
- Структуры, обеспечивающие движение клеток…
- Стопки мембранных цилиндров, пузырьков, в которые упаковываются синтезированные в клетке вещества…
- Клеточная структура, содержащая генетический материал в форме ДНК, — …
- Регуляция поступления веществ в клетку осуществляется с помощью…
- Двумембранные органеллы клетки, в которых идет запасание энергии в виде молекул АТФ, — …
- Одномембранные структуры с продуктами обмена, характерные для растительных клеток…
- Органеллы клетки, в которых осуществляется синтез сахара, — …
- Пористая структура из целлюлозы, придающая клетке прочность и постоянную форму — …
- Одномембранные структуры с гидролитическими ферментами, осуществляющими автолиз, — …
- Складки мембраны метахондрий, увеличивающие общую площадь поверхности, — …
- Основное вещество клетки, в котором находятся все органеллы, — …
- Полые цилиндры, состоящие из микротрубочек и участвующие в делении клетки, — …
Учитель задает дополнительные вопросы.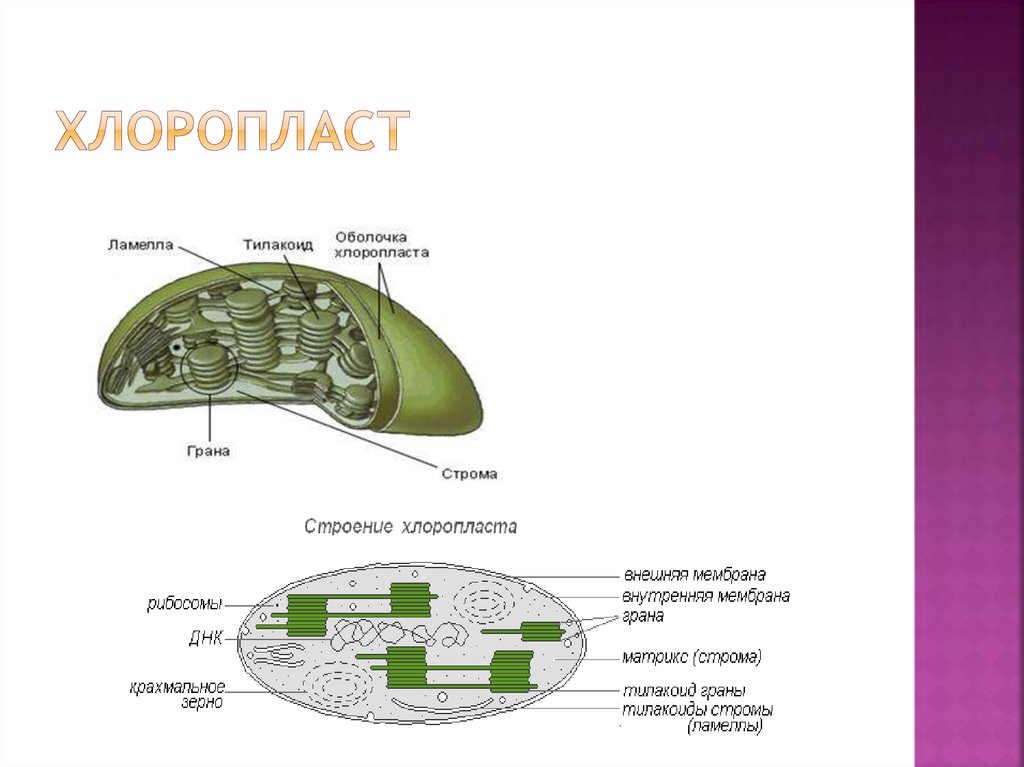
IV. Повторение химического состава клетки (устное выполнение теста № 2, разбор отдельных вопросов с комментарием).
Тест № 2. Химический состав клетки.
Выберите правильные ответы на каждую предложенную информацию.
1. К макроэлементам биогенам относятся:
а) C, H, O, S, Cl, Mg
б) H, O, C, N, S, P
в) H, O, C, Fe, K, I
2. Вода обладает способностью растворять вещества, потому что:
а) ее молекулы полярны
б) атомы в ее молекуле соединены ионной связью
в) между ее молекулами образуются водородные связи
3. Ионы К+ поступают через мембрану внутрь клетки:
а) диффузией
б) осмосом
в) активным транспортом
4. Фосфор входит в состав:
а) липидов
б) белков
в) углеводов
5. Мономерами нуклеиновых кислот являются:
а) азотистые основания
б) рибоза или дезоксирибоза
в) нуклеотид
6. Вторичная структура белка поддерживается:
Вторичная структура белка поддерживается:
а) пептидными связями
б) водородными связями
в) дисульфидными ковалентными связями
7. Из аминокислотных остатков построены молекулы:
а) углеводов
б) белков
в) липидов
8. Наиболее энергоемкими являются:
а) жиры
б) нуклеиновые кислоты
в) белки
9. Для ДНК характерны следующие азотистые основания:
а) аденин, гуанин, цитозин, урацил
б) аденин, цитозин, тимин, урацил
в) аденин, гуанин, цитозин, тимин
10. К полимерам относятся:
а) крахмал, белок, целлюлоза
б) белок, гликоген, жир
в) целлюлоза, сахароза, крахмал
11. Гормональную функцию могут выполнять:
а) только белки
б) белки и липиды
в) белки, липиды и углеводы
12. Состав ДНК от РНК отличается содержанием:
а) сахара
б) азотистых оснований
в) сахара и азотистых оснований
13. Аминокислоты в молекуле белка соединены
посредством:
Аминокислоты в молекуле белка соединены
посредством:
а) ионной связи
б) пептидной связи
в) водородной связи
14. Клеточная мембрана построена из:
а) фосфолипидов и белков
б) жиров и белков
в) углеводов и липидов
15. Ферменты – это биокатализаторы, состоящие из:
а) белков
б) липидов
в) нуклеотидов.
V. Повторение механизма матричного биосинтеза белка (устный ответ у доски, заполнение таблицы № 1).
Таблица № 1. Вещества и структуры клетки, участвующие в синтезе белковой молекулы.
| Вещества и структуры | Функции |
| 1. ДНК | Содержат информацию о структуре белка. Служит матрицей для синтеза и — РНК. |
| 2. и — РНК | Переносит информацию о
последовательности аминокислот в белке с ДНК к
месту синтеза белка. Служит матрицей для синтеза
молекул белка. Служит матрицей для синтеза
молекул белка. |
| 3. т — РНК | Доставляет аминокислоты в функциональный центр рибосомы. |
| 4. Рибосома | Осуществляет сборку белковой молекулы. |
| 5. Ферменты | |
| 6. Аминокислоты | Служат строительным материалом при построении белковой молекулы. |
| 7. АТФ | Обеспечивают биосинтезбелка необходимой энергией. |
VI. Обобщение учителя: “Мы все наследники ДНК”, напомнить обучаемым о доктрине ЗОЖ в республике Саха (Якутия).
VII. Повторение механизма фотосинтеза используя и демонстрируя медиакадры по следующему плану:
- Условия фотосинтеза
- Механизм световой фазы
- Механизм темновой фазы
- Значение фотосинтеза (запись в тетради обучаемых):
- Создаваемые растением органические вещества и
кислород в целом обеспечивают существование
всего живого на Земле.

- Фотосинтез препятствует увеличению концентрации CO2 в атмосфере, предотвращая перегрев Земли (парниковый эффект).
- Созданное им атмосфера (озоновый слой) защищает живое от губительного УФ – излучения (кислородно-озоновый экран атмосферы).
- Растения вовлекают в кругооборот миллиарды тонн азота, фосфора, серы, магния, кальция, калия.
VIII. Решение задач по молекулярной биологии для закрепления знаний.
Задача 1.
Смысловая нить ДНК соответствующая гену вазопрессина (гормона гипофиза, повышающего кровяное давление), содержит следующую последовательность нуклеотидов: АЦААТААААЦТТЦТААЦАГГАГЦАЦЦА
Определите:
1. Последовательность нуклеотидов во второй нити ДНК;
2. Последовательность нуклеотидов в и-РНК, соответствующей гену вазопрессина
3. число аминокислот, входящих в состав вазопрессина.
Решение: кДНК: АЦА-АТА-ААА-ЦТТ-ЦТА-АЦА-ГГА-ГЦА-ЦЦА
нк ДНК: ТГТ- ТАТ-ТТТ- ГАА-ГАТ-ТГТ- ЦЦТ- ЦГТ-ГГТ
и РНК: УГУ- УАУ-УУУ-ГАА-ГАУ-УГУ-ЦЦУ-ЦГУ-ГГУ
пептид: цис – тир – фен – глу – АСП – цис – про – арг – гли
Задача № 2.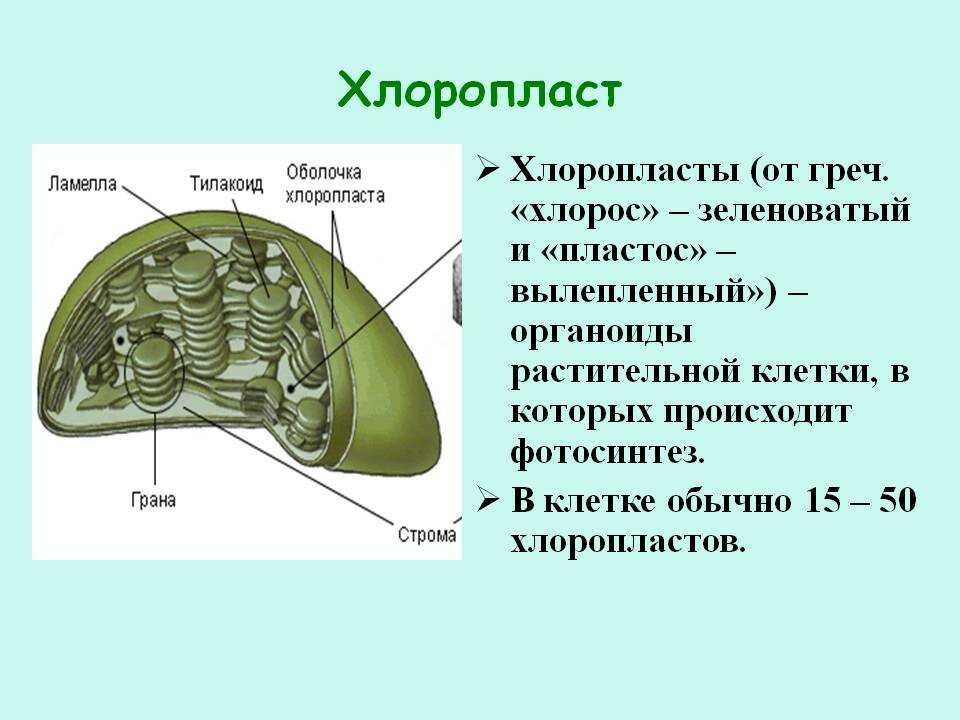
Укажите изменения в строении пептида, если в кодирующей цепи ДНК (ГТА-ГЦТ-ААА-ГГГ) гуанин из положения 1 перешел в 8 положение.
Решение: к ДНК:ГТА-ГЦТ-ААА-ГГГ, после мутации к- ДНК имеет вид:
ТАГ-ЦТА-АГА-ГГГ
и-РНК: ЦАУ-ЦГА-УУУ-ЦЦЦ
пептид I: гис – арг – фен — про
и-РНК: АУЦ-ГАУ-УЦУ-ЦЦЦ
пептид II: еле – асп –сер –про
Ответ: вместо гис – иле, арг – асп, фен — сер
IX. Домашнее задание. Подготовиться к зачету по темам: “Биосинтез белка” и “Фотосинтез”.
Х. Комментарий оценок
Фотосинтез. Световая фаза.
Автор Чергинцев Д. А.
Прежде чем перейти непосредственно к рассмотрению фотосинтеза, на всякий случай напомним немного про органеллы, в которых происходит большинство реакций, связанных с этим процессом – про хлоропласты. Пластиды были приобретены предком Архепластид как минимум 1,2 млрд лет назад путем эндосимбиоза с цианобактерией (см приложения в конце статьи). Архепластиды — супергруппа в современной систематике, включающая красных, зеленых, глаукофитовых, криптофитовых (Adl et al.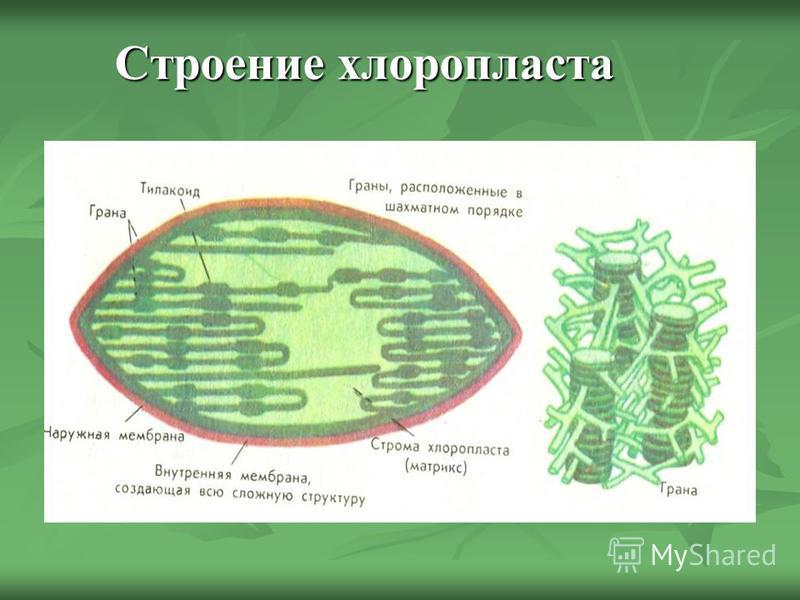 , 2018) водорослей, группу Streptophyta (харовые в широком смысле и наземные растения) и прочие группы.
, 2018) водорослей, группу Streptophyta (харовые в широком смысле и наземные растения) и прочие группы.
Хлоропласт, как и все пластиды – двумембранная органелла клетки. Наружная мембрана имеет происхождение из наружной мембраны цианобактерий, она проницаема для многих низкомолекулярных органических соединений. В наружной мембране содержится большое количество рецепторов и транслокаторов, за счет которых осуществляется обмен с внешней средой.
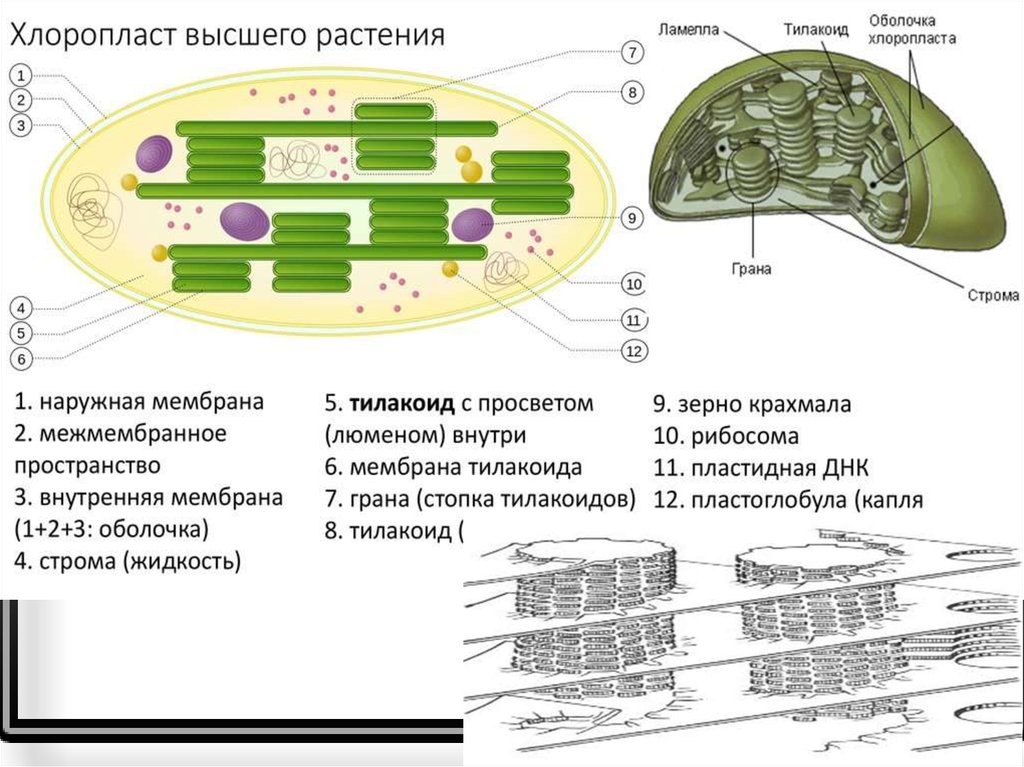
Внутренняя мембрана, о которой речь будет идти и далее, обладает высокой избирательностью проницаемости, контролирует транспорт, является основным барьером, разделяющим внутреннее содержимое пластиды от цитоплазмы и разграничивающим различные компартменты самого хлоропласта. По происхождению она соответствует цитоплазматической мембране цианобактерии. Внутренняя мембрана образует обширную мембранную сеть внутри хлоропласта, образуя тилакоиды (небольшие мембранные пузырьки), часто собранные в стопки или граны и крупные свободные ламеллы стромы.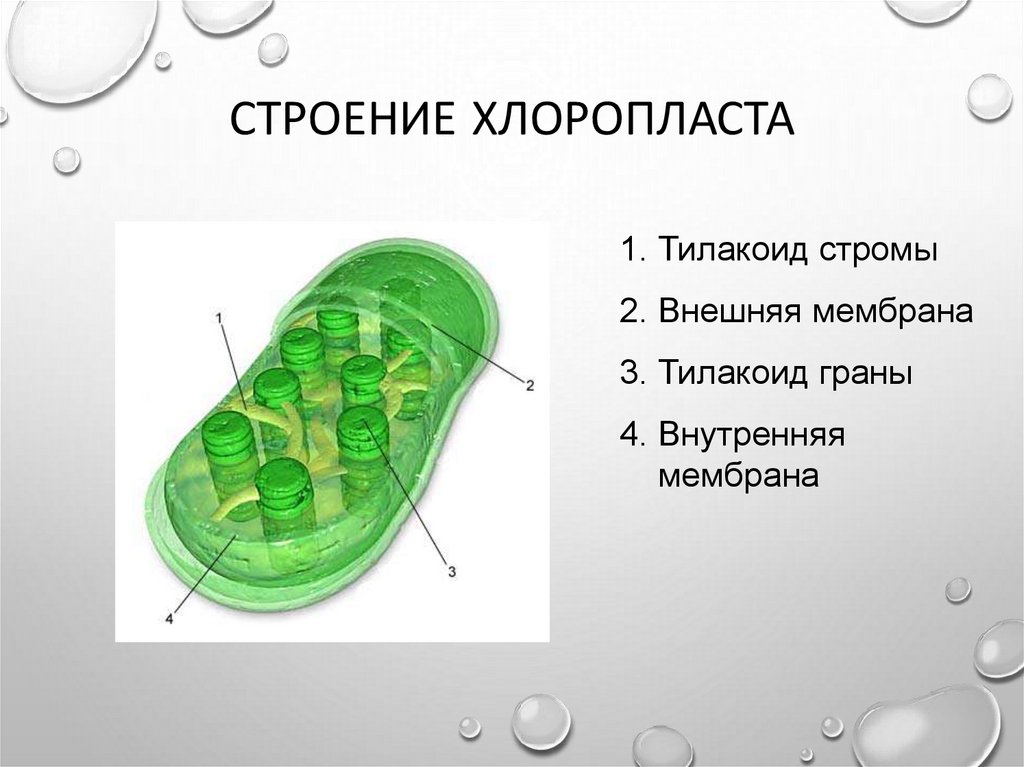 Внутреннее пространство тилакоида и ламеллы называется люменом.
Внутреннее пространство тилакоида и ламеллы называется люменом.
В высших растениях может быть большое разнообразие различных пластид, но в одной клетке только один тип. При этом многие типы пластид могут обратимо друг в друга превращаться.
Фотосинтез – один из основополагающих процессов биосферы, это наиболее мощный механизм преобразования солнечной энергии в энергию химических связей, что делает его роль ключевой в биоэнергетике как растений, так и животных.
Реакции фотосинтеза традиционно делят на две стадии – темновую и световую. И тут важно понимать, что, несмотря на название, обе стадии идут только на свету! Это объясняется тем, что многие ферменты, катализирующие ключевые реакции, активны только на свету. Более того, для многих из них обнаружена зависимость от циркадных ритмов, внутренних часов организма, определяющих суточную ритмику различных процессов.
Световая фаза фотосинтеза включает в себя разнообразные процессы, основная цель которых – преобразование солнечной энергии в энергию химических связей.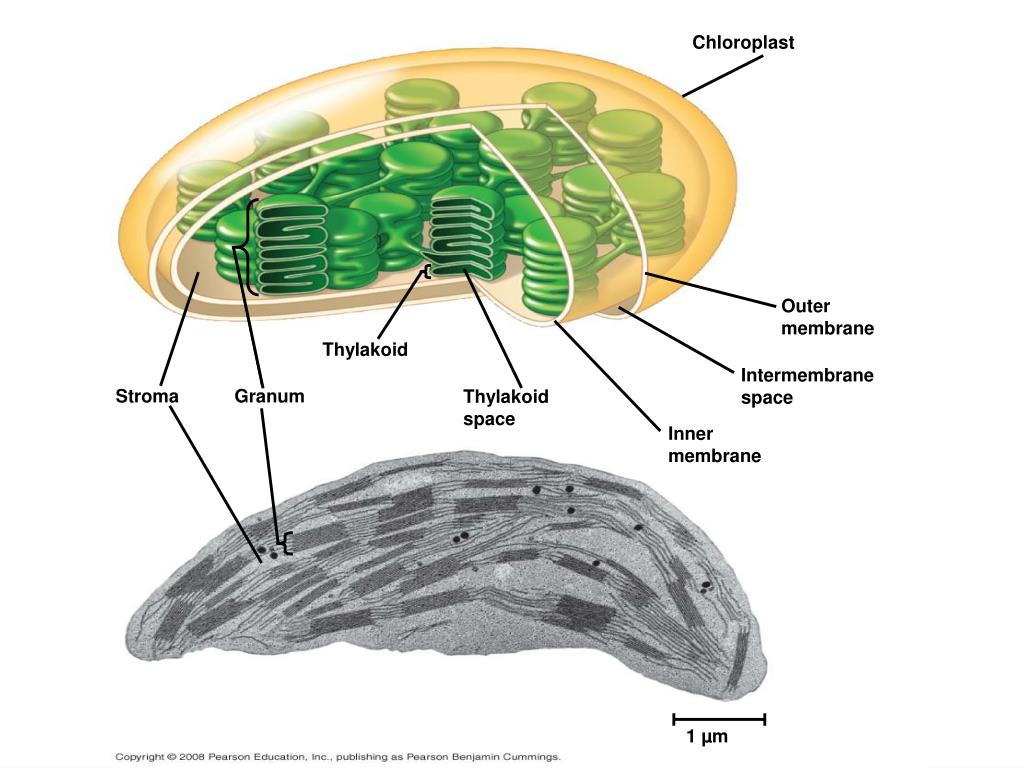 Эти процессы локализованы на мембране тилакоида. По сути люмен тилакоида аналогичен межмембранному пространству митохондрии. Как и внутренняя мембрана митохондрии оболочка тилакоида представляет собой сопрягающую мембрану. Сопрягаются и в том и другом случае процессы перекачки протонов и перенос электронов по электрон-транспортной цепи. Далее за счет градиента протонов синтезируется АТФ, а электроны восстанавливают NADP+ до NAPDH+H+.
Эти процессы локализованы на мембране тилакоида. По сути люмен тилакоида аналогичен межмембранному пространству митохондрии. Как и внутренняя мембрана митохондрии оболочка тилакоида представляет собой сопрягающую мембрану. Сопрягаются и в том и другом случае процессы перекачки протонов и перенос электронов по электрон-транспортной цепи. Далее за счет градиента протонов синтезируется АТФ, а электроны восстанавливают NADP+ до NAPDH+H+.
Вообще, в клетках есть две основные формы энергии – энергия химических связей (АТФ, например) и энергия градиентов (градиент протонов у растений, натрия – у животных), с которой неразрывно связана разность потенциалов и для создания которой необходима мембрана с жестко контролируемой проницаемостью. Не очень корректно, но использование энергии градиента можно сравнить с принципом работы гидроэлектростанций, где за счет разницы давления воды раскручиваются турбины и вырабатывается электричество. Эти две формы энергии обязательно присутствуют в любой живой клетке, а также могут быть конвертированны одна в другую.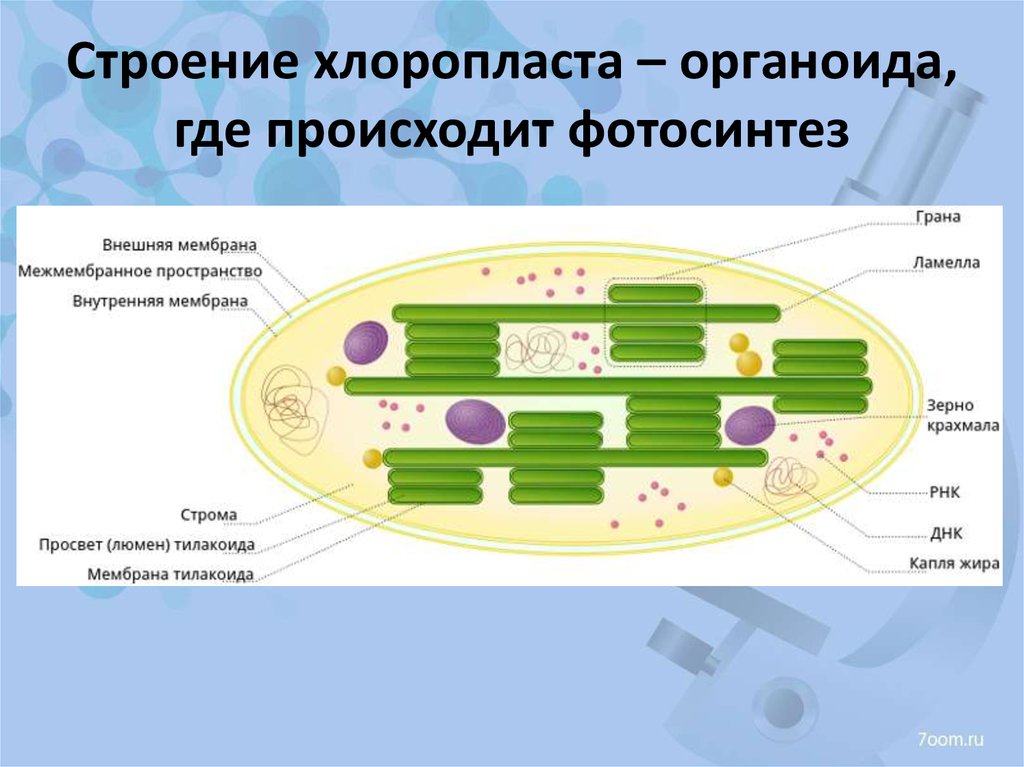 На этом факте основаны многие задания на олимпиадах, которые могут звучать как-то так:
На этом факте основаны многие задания на олимпиадах, которые могут звучать как-то так:
Рассчитайте сколько молекул АТФ может синтезироваться в митохондрии в аэробных условиях при полном окислении сахарозы?
Электронно транспортная цепь со сложным механизмом сопряжения возникла не сразу. Но рассмотрим все по порядку и начнем с предыстории.
Основными пигментами, участвующими в реакциях световой фазы являются хлорофиллы у эукариотических фотосинтезирующих организмов или бактериохлорофиллы у прокариотических, но самый первый механизм преобразования энергии света не задействовал эти пигменты. Речь про родопсиновый фотосинтез, встречаемый у группы архей Euryarchaeota (Halobacteria). Этот тип примечателен своим потрясающе простым устройством. Ключевым ферментом является собственно пигмент-белковый комплекс – бактериородопсин, в котором содержится ретиналь. Да, именно тот самый, что и в наших зрительных рецепторах. Под действием света ретиналь претерпевает цис-транс переход, что приводит к конформационным изменениям бактериородопсина и переносу протона из цитоплазмы наружу.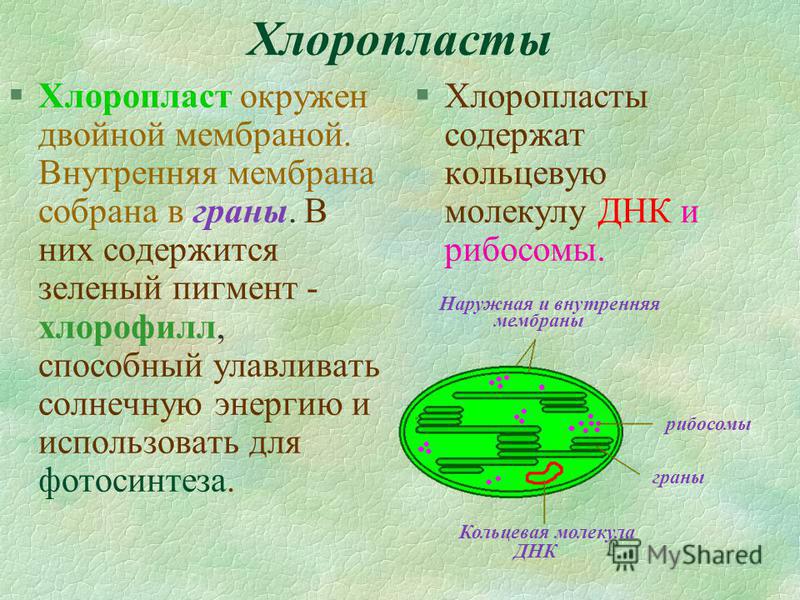 Таким образом создается протонный градиент, который далее используется для синтеза АТФ на АТФ-синтазе (в данном случае не обычная, а архейного типа, похожая на вакуолярную АТФ-синтазу V-типа у растений). Прекрасный механизм, ничего лишнего!
Таким образом создается протонный градиент, который далее используется для синтеза АТФ на АТФ-синтазе (в данном случае не обычная, а архейного типа, похожая на вакуолярную АТФ-синтазу V-типа у растений). Прекрасный механизм, ничего лишнего!
Хлорофилльный фотосинтез появился позднее. Несмотря на все разнообразие хлорофиллов, только хлорофилл а и бактериохлорофилл а, располагаясь в димерах, могут непосредственно преобразовывать энергию света.
Все хлорофиллы имеют тетрапиррольную структуру порфирина, которая преимущественно и определяет свойства молекулы. Молекула плоская, несет систему сопряженных двойных связей, формирующих π-электронное облако, благодаря чему может довольно легко вступать в процессы фотоокисления (отдавать электрон) или фотовосстановления (принимать электрон). В центре хелатирован магний, который сильно влияет на свойства молекулы – выравнивает и перераспределяет электронную плотность по кольцам порфирина, образует координационные связи с молекулами воды, аминокислотными остатками, участвует в формировании димерных структур реакционных центров фотосистем.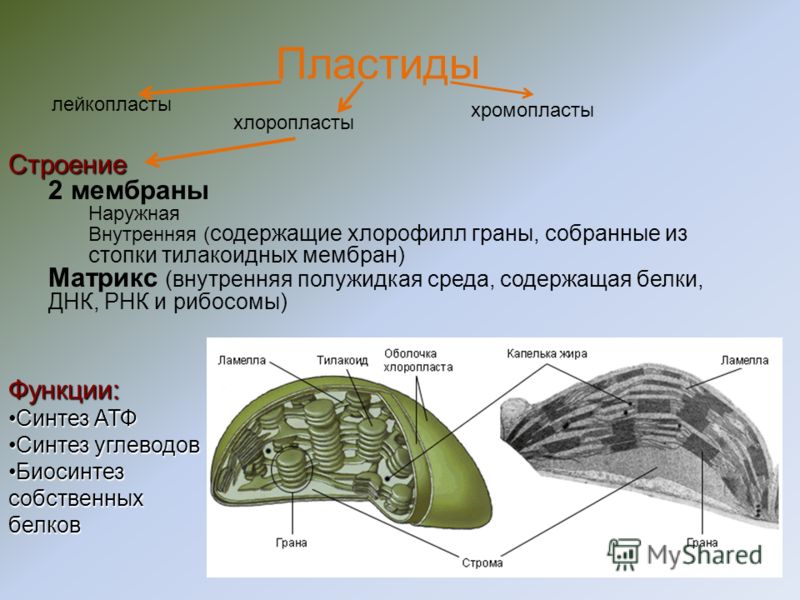 Также имеются полярные периферические группы, которые определяют взаимодействия хлорофиллов с различными компонентами хлоропласта. У многих хлорофиллов помимо тетрапиррольного кольца есть еще фитольный хвост. Фитол – дитерпеноид, содержащий 20 атомов углерода. Фитол практически не влияет на спектральные свойства хлорофилла, но определяет его взаимодействие с гидрофобной фракцией мембран и белков.
Также имеются полярные периферические группы, которые определяют взаимодействия хлорофиллов с различными компонентами хлоропласта. У многих хлорофиллов помимо тетрапиррольного кольца есть еще фитольный хвост. Фитол – дитерпеноид, содержащий 20 атомов углерода. Фитол практически не влияет на спектральные свойства хлорофилла, но определяет его взаимодействие с гидрофобной фракцией мембран и белков.
Синтез хлорофиллов идет в хлоропластах из глутамата, также как и синтез гемов (часть биосинтетического пути общая). Сначала происходят преобразования глутамата, получается соединение с пятичленным гетероциклом – порфобилиноген. Четыре порфобилиногена соединяются, получившаяся молекула претерпевает несколько превращений и получается протопорфирин IX. На этом соединении и образуется развилка в синтезах гемов и хлорофиллов. Если в соединение включается Mg2+, образуется Mg-протопорфирин и далее реакции идут по направлению биосинтеза хлорофилла. В темноте синтез хлорофиллов не может быть завершен, так как и ферменты контролируются светом и есть реакция, которая в принципе не идет в темноте.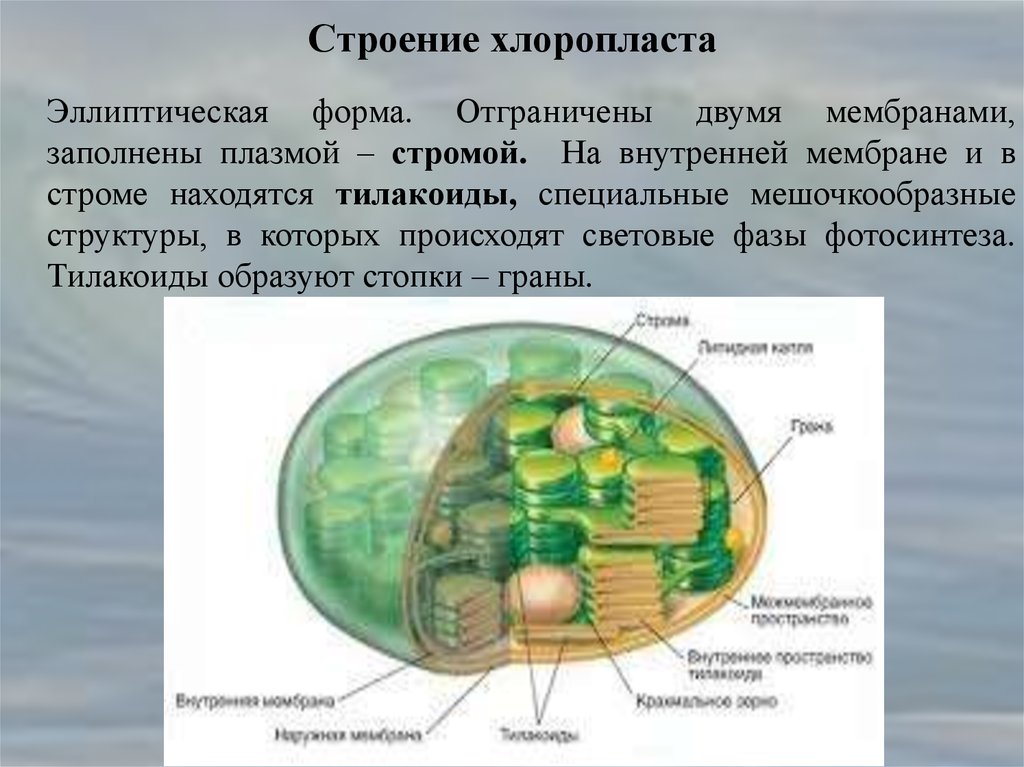 Последним этапом синтеза хлорофилл-синтаза присоединяет к тетрапирролу фитольный хвост, получается хлорофилл а. Все остальные хлорофиллы синтезируются из него.
Последним этапом синтеза хлорофилл-синтаза присоединяет к тетрапирролу фитольный хвост, получается хлорофилл а. Все остальные хлорофиллы синтезируются из него.
Хлорофилл а является основным фотосинтетическим пигментом эукариотических фотосинтезирующих организмов, цианобактерий (у которых это единственная форма хлорофилла). Максимумы поглощения приблизительно 430 и 670 нм, то есть в синей и красной области. Между этими максимумами «зеленый провал», в котором хлорофиллы практически не поглощают.
Хлорофилл b – дополнительный пигмент, характерный для высших растений, выполняет в основном светособирающую роль. Красноволновый максимум поглощения несколько сдвинут в коротковолновую область, благодаря чему «зеленый провал» несколько сужается.
Разнообразные формы хлорофилла с обнаруживаются у Dinophyta и Stramenopiles. У этого типа пигментов нет фитольного хвоста.
Хлорофилл d, f – цианобактериальные. В некоторой литературе можно найти, что хлорофилл d есть у красных водорослей, но это ошибка.
Хлорофилл e – по некоторым довольно старым источникам, имеется у одного лишь представителя Xanthophyceae.
Бактериохлорофиллов тоже много (a, b, c, d, e, f, g), основной – бактериохлорофилл a. Для бактериохлорофиллов характерны длинноволновые максимумы поглощения.
Тетрапиррольные пигменты могут быть не только циклические, но и линейные, называемые фикобилинами. Различают фикоэритрин, фикоцианин и аллофикоцианин (по увеличению длины волны максимумов поглощения). Фикобилины есть, например, у цианобактерий, красных и криптофитовых водорослей, где они выполняют роль светособирающих антенн. У цианобактерий и красных водорослей — фикобилипротеины.
Помимо хлорофиллов в пигментных системах в обязательном порядке присутствуют каротиноиды – кислород-содержащие (ксантофиллы) и бескислородные (каротины). Это изопреноидные соединения с 40 атомами углерода, биосинтез которых происходит в пластидах. Благодаря длинной цепи сопряженных связей каротиноиды способны поглощать свет, передавать энергию возбуждения хлорофиллам, а также диссипировать ее в тепло.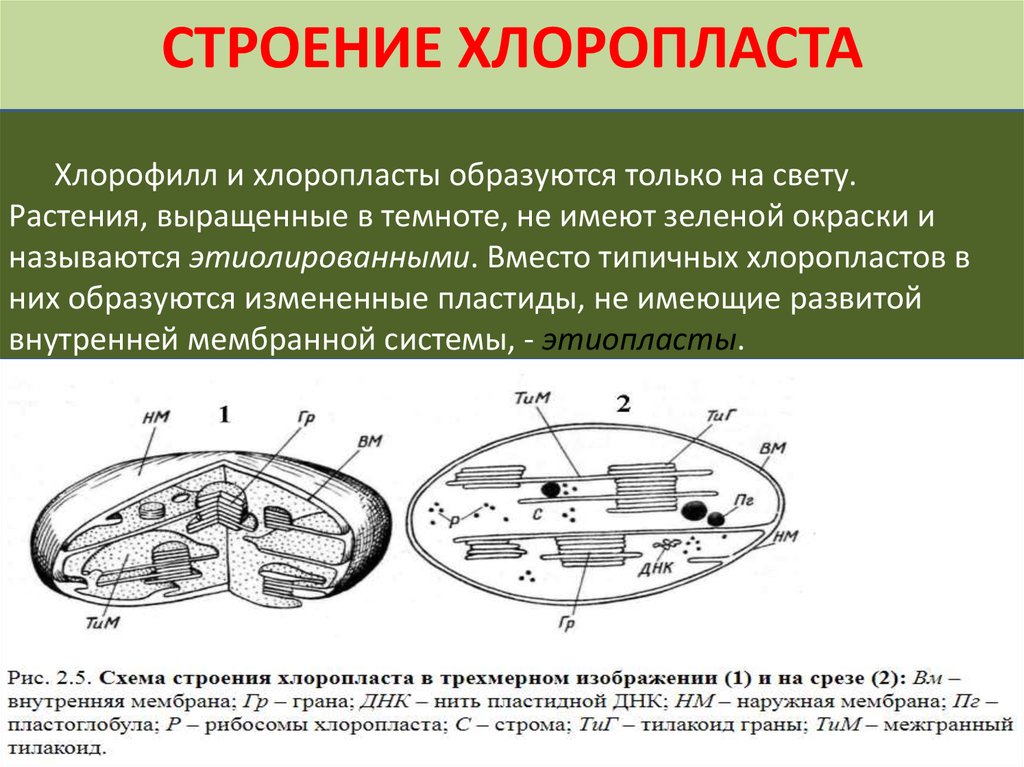 Этим частично объясняются фотопротекторные функции этих пигментов. Каротиноиды также могут забирать от хлорофиллов избыток энергии, тушить триплетный хлорофилл, защищать от активных форм кислорода (синглетный кислород, супероксидрадикал) и органических радикалов. Помимо этого, каротиноиды участвуют в структуризации мембран, определяют конформацию пигмент-белковых комплексов, придают окраску различным частям растений.
Этим частично объясняются фотопротекторные функции этих пигментов. Каротиноиды также могут забирать от хлорофиллов избыток энергии, тушить триплетный хлорофилл, защищать от активных форм кислорода (синглетный кислород, супероксидрадикал) и органических радикалов. Помимо этого, каротиноиды участвуют в структуризации мембран, определяют конформацию пигмент-белковых комплексов, придают окраску различным частям растений.
Что же все-таки такое антенна? Антенна – совокупность пигмент-белковых комплексов, способная улавливать свет и передавать энергию к реакционному центру.
Основная функция – увеличить площадь сбора световой энергии. В антеннах пигменты (хлорофиллы и каротиноиды) очень тесно друг с другом взаимодействуют, что позволяет им обмениваться энергией. Говоря очень упрощенно, по антеннам перемещается экситон – некоторое возбужденное состояние, которое передается от пигмента с большей энергией возбуждения к пигменту с меньшей, попадая в конечном счете на реакционный центр, который таким образом выступает в качестве энергетической ловушки. Все процессы происходят очень быстро – за пикосекунды. Если говорить чуть подробнее, то в антеннах между хлорофиллами энергия передается путем образования переменного электрического поля между двумя пигментами, предлагается механизм осциллирующего диполя. Можно это представить на некотором механическом аналоге – в виде связанных колебаний.
Все процессы происходят очень быстро – за пикосекунды. Если говорить чуть подробнее, то в антеннах между хлорофиллами энергия передается путем образования переменного электрического поля между двумя пигментами, предлагается механизм осциллирующего диполя. Можно это представить на некотором механическом аналоге – в виде связанных колебаний.
Представьте два шарика на упругих нерастяжимых подвесах, соединенных неким передаточным механизмом. Если начать периодически колебать один шарик, то со временем колебания передадутся на другой. На рисунке 9 схематично изображены процессы происходящие при этом на электронных орбиталях молекул.
Миграция энергии от каротиноида к хлорофиллу может идти и иным механизмом, что связано с особенностями возбуждения каротинов и стабильностью их возбужденных состояний.
Таким образом, в антеннах передается именно энергия, а все электроны остаются связанными со своими молекулами. В реакционном центре же под действием этой энергии происходит разделение зарядов в димере хлорофилла а и выбитый электрон поступает в электрон-транспортную цепь, на акцептор (см рисунок 7).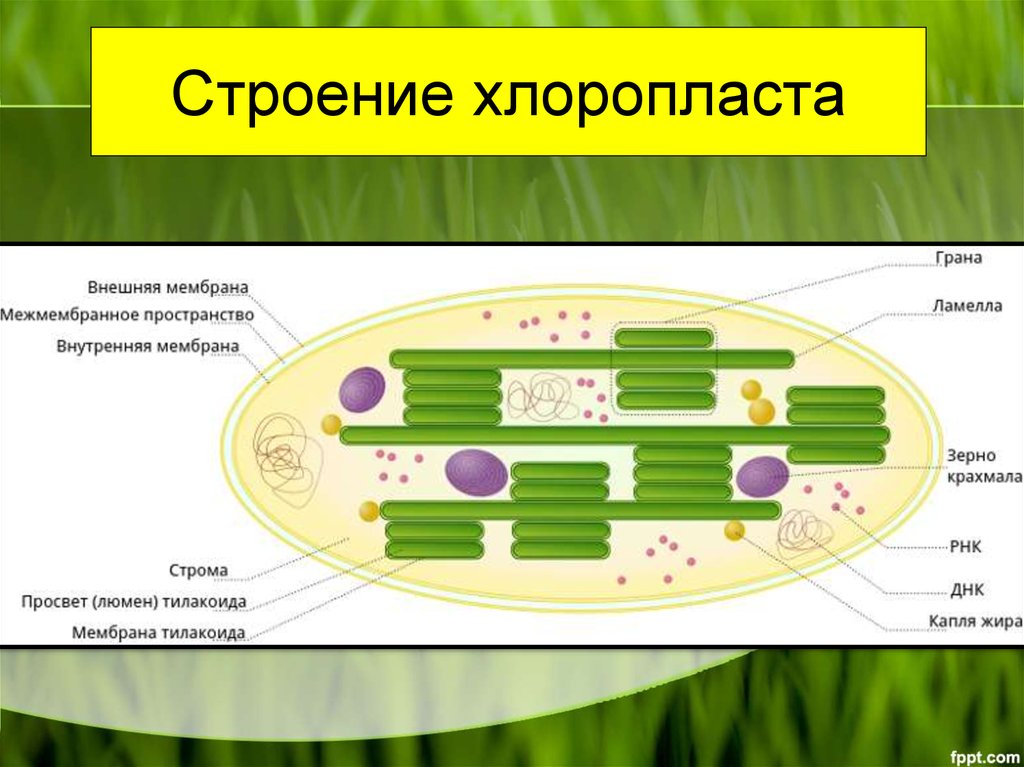 А образовавшаяся «дырка» на пигменте реакционного центра восполняется за счет притока электронов от донора.
А образовавшаяся «дырка» на пигменте реакционного центра восполняется за счет притока электронов от донора.
Существует несколько механизмов, каким образом восполнить ушедший электрон, в качестве доноров могут выступать различные соединения. Например, сероводород у анаэробных фотосинтезирующих зеленых серных бактерий, вода у эукариот и цианобактерий или пул хинолов, который в свою очередь принял электроны от фотосистемы. Но обо всем по порядку.
Электрон-транспортная цепь (ЭТЦ) хлоропласт высших растений состоит из двух фотосистем (ФС I и ФС II), цитохромного комплекса (цитохром b6/f), пула хинонов, пластоцианина, светособирающих антенн и некоторых стромальных белков.
В ЭТЦ есть несколько типов переносчиков.
Хиноны (окисленная форма, восстановленная – хинол) – гидрофобные двуэлектронные, располагаются внутри мембраны. Могут находиться в трех состояниях окисленности-восстановленности (редокс статус). Переносят электроны со второй фотосистемы на цитохромный комплекс. Помимо электронов переносят также и протоны, благодаря чему формируется протонный градиент.
Пластоцианин – медь-содержащий одноэлектронный белковый переносчик, располагающийся в люмене тилакоида.
Гемы – одноэлектронные переносчики, кофакторы цитохромов.
Железосерные кластеры – комплексы, состоящие из элементов железа и серы. Различаются по геометрии, числу и соотношению железа и серы. Непосредственно связаны с аминокислотами белков – цистеином и гистидином чаще всего. Переносят один (Fe-S, 2Fe-2S) или 2 электрона (4Fe-4S) за счет изменения степени окисленности железа. Железосерные кластеры имеются в цитохромном комплексе (белок Риске), в первой фотосистеме и в ферредоксине. Ферредоксин – стромальный белок, принимающий электроны от первой фотосистемы и передающий их на NADP+.
Прежде чем поговорить об ЭТЦ высших растений, необходимо сперва упомянуть прототипы ее компонентов.
Вторая фотосистема берет свое начало от фотосистемы пурпурных бактерий.
Система димерная (на рисунке 13 не показано), состоит из двух очень похожих белков (L и M), которые несут в себе одинаковые по переносчикам транспортные цепи (бактериохлорофилл-бактериофеофитин-хинон), но работает только цепь на L белке.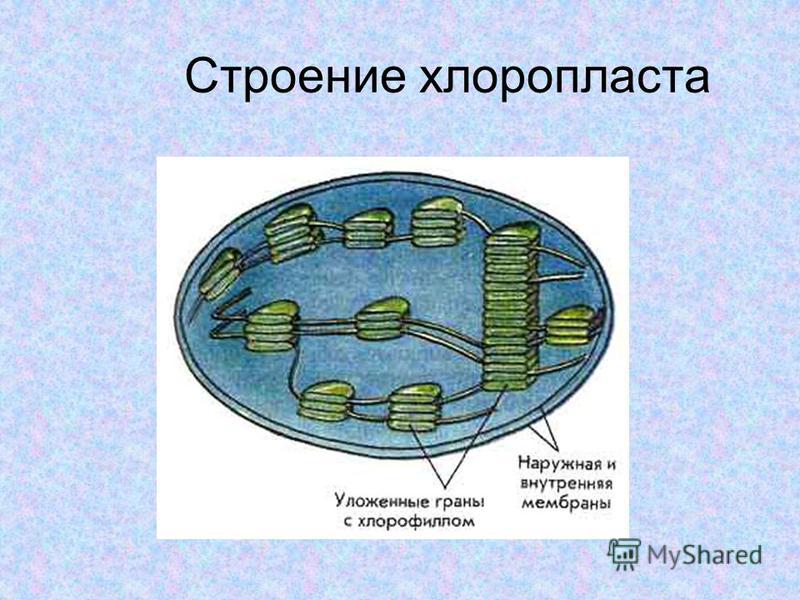 Еще существует крупная субъединица H, которая защищает ЭТЦ внутри фотосистемы от внешних акцепторов. Пигментом в реакционном центре здесь является P870. Первичный акцептор электронов – бактериофеофитин (хлорофилл без магния, но с двумя протонами вместо него). Здесь же участвует бактериохлорофилл (BChl800). С бактериофеофитина электрон поступает на хиноны. QA (QLMQ) – связанный хинон, QB (QMPQ) – свободный, выходит в мембрану и несет два электрона к цитохромному комплексу, где окисляется, отдавая электроны и выносит два протона в люмен. Тут не b6/f цитохром, а bc1, как в митохондриях. С цитохрмного комплекса электроны поступают на подвижный люменальный цитохром с, который возвращает их на реакционный центр.
Еще существует крупная субъединица H, которая защищает ЭТЦ внутри фотосистемы от внешних акцепторов. Пигментом в реакционном центре здесь является P870. Первичный акцептор электронов – бактериофеофитин (хлорофилл без магния, но с двумя протонами вместо него). Здесь же участвует бактериохлорофилл (BChl800). С бактериофеофитина электрон поступает на хиноны. QA (QLMQ) – связанный хинон, QB (QMPQ) – свободный, выходит в мембрану и несет два электрона к цитохромному комплексу, где окисляется, отдавая электроны и выносит два протона в люмен. Тут не b6/f цитохром, а bc1, как в митохондриях. С цитохрмного комплекса электроны поступают на подвижный люменальный цитохром с, который возвращает их на реакционный центр.
Этот тип фотосинтеза позволяет накачать протоны и синтезировать АТФ но не дает восстановительного эквивалента (NADPH), который пурпурным бактериям приходится образовывать, используя обратный транспорт электронов по ЭТЦ. Но это уже совсем другая история.
Фотосистема зеленых серных бактерий является прообразом первой фотосистемы эукариот и цианобактерий.
Пигмент в данном случае – Р840. Первичный акцептор – бактериохлорофилл A0, далее электрон идет на филлохинон А1 (витамин К1) и на железосерные кластеры Fx, FA, FB, с них на ферредоксин (ФД). Ферредоксин взаимодействует с фд-NADPH-оксидоредуктазой которая восстанавливает NADPH электронами с ФД. В данном случае электрон израсходован на образование восстановительного эквивалента, но надо также, как и в предыдущем случае, заполнить образовавшуюся «дырку» на пигменте реакционного центра. У зеленых серных фотосинтезирующих бактерий донором является сероводород, который, отдавая электроны, окисляется до серы или сульфатов. Отобранные от h3S электроны поступают через хинолы на цитохромный комплекс (снова bc1), а затем переносятся цитохромом с на реакционный центр. В данном случае, в противоположность тому, что имеется у пурпурных, идет образование NADPH, но не АТФ. Позволить себе получать сразу и NADPH и АТФ могут только эукариоты и цианобактерии, которые, вообще говоря, и дали начало пластидам.
В хлоропластах и цианобактериях ЭТЦ представляет собой комбинирование двух описанных бактериальных систем (рисунок 15).
Окислительно-восстановительный (редокс) потенциал – способность химического вещества присоединять электроны. Выражается в милливольтах. Чем более отрицательные значения принимает редокс потенциал, тем лучшим донором электронов является вещество, чем более положительный – более сильным акцептором. Обратите внимание, что на схемах (рисунки 13-16) ось ординат отображает восстановительную способность, поэтому отрицательные значения сверху.
На рисунках 16 и 17 схематично показана общая логика процессов, происходящих в ЭТЦ. Пигмент ФСII, Р680 – очень сильный окислитель, но его восстановительная сила в возбужденном состоянии Р680* относительно невысока, ее не хватит для восстановления NADPH. Пигмент второй фотосистемы, Р700 – не очень сильный окислитель, но Р700* имеет очень высокую восстановительную способность. Таким образом, роль первой фотосистемы при функционировании полной ЭТЦ – восстановление NADPH.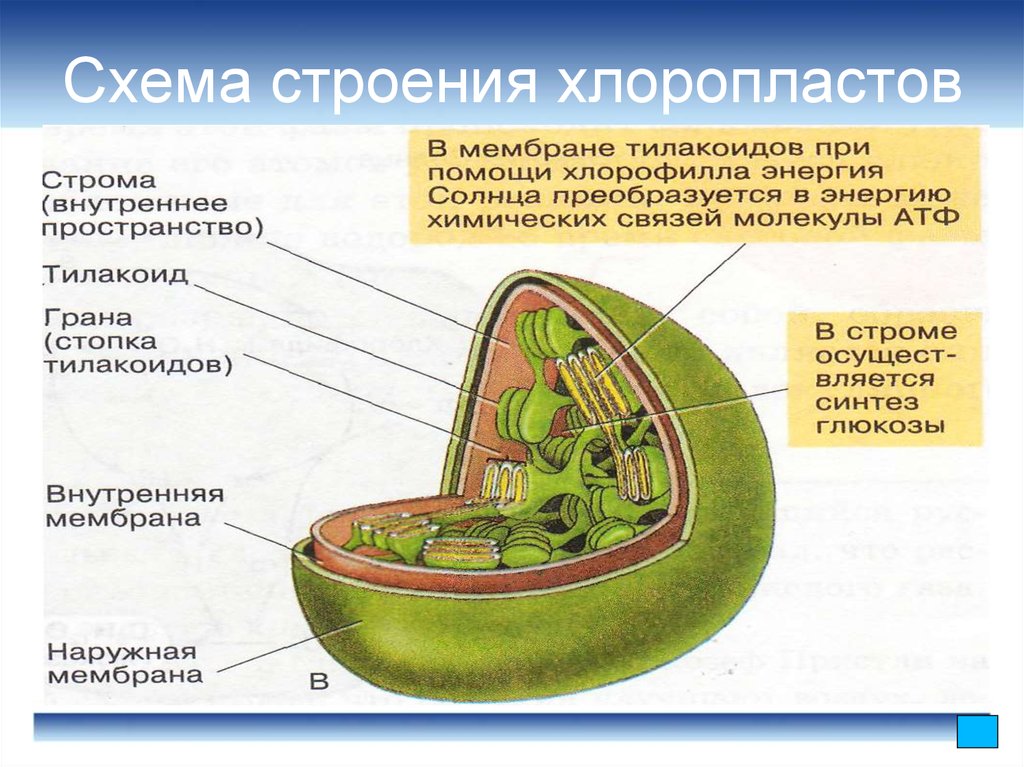 Происходит это после возбуждения P700 вспышкой света («Photon» на рисунке) и ухода электрона по ЭТЦ первой фотосистемы на ферредоксин. Ушедший электрон восполняется электроном, выбитым из второй фотосистемы. По пути переноса электронов от ФСII к ФСI совершается работа – перекачивание протонов, создание градиента, за счет которого далее синтезируется АТФ.
Происходит это после возбуждения P700 вспышкой света («Photon» на рисунке) и ухода электрона по ЭТЦ первой фотосистемы на ферредоксин. Ушедший электрон восполняется электроном, выбитым из второй фотосистемы. По пути переноса электронов от ФСII к ФСI совершается работа – перекачивание протонов, создание градиента, за счет которого далее синтезируется АТФ.
Таким образом, электроны от ФСII восстанавливают Р700+ ФСI, и снова возникает проблема донора электронов, уже для второй фотосистемы. Чисто теоретически донором может быть все тот же сероводород, как у зеленых серных бактерий. Сероводород довольно легко окислить и продукт окисления довольно инертен и неопасен. Но сероводорода мало на Земле. А вот воды много. При этом вода – очень плохой восстановитель, очень трудно отобрать у нее электроны. Более того, продукты окисления высокоактивны и могут вызывать повреждения. Но фактор распространения оказался решающим, вода используется в качестве донора электронов: 2h3O 4e-+4H++O2. Именно очень сильный окислительный потенциал P680 позволяет существовать оксигенному фотосинтезу, который появился где-то 2,1-2,5 млрд лет назад у цианобактерий. Помимо огромного преимущества, для самих фотосинтетиков — это событие сыграло одну из ключевых ролей в формировании атмосферы, что называется кислородной катастрофой, именно оксигеный фотосинтез определил создание условий, пригодных для развития сложных форм жизни на Земле.
Именно очень сильный окислительный потенциал P680 позволяет существовать оксигенному фотосинтезу, который появился где-то 2,1-2,5 млрд лет назад у цианобактерий. Помимо огромного преимущества, для самих фотосинтетиков — это событие сыграло одну из ключевых ролей в формировании атмосферы, что называется кислородной катастрофой, именно оксигеный фотосинтез определил создание условий, пригодных для развития сложных форм жизни на Земле.
Сам процесс окисления воды происходит в марганцевом кластере – сложноустроенном белковом комплексе, в реакционном центре которого содержится, помимо прочего, 4 марганца, хлор и кальций (см рис 19), связанных с аминокислотными остатками. Кластер может постепенно отдавать по одному электрону на реакционный центр ФСII, восстанавливая пигмент Р680+, отдавший электрон в ЭТЦ. Посредником между Р680 и марганцевым кластером является Tyr Z (тирозин-161 белка D1 второй фотосистемы). Марганцевый кластер, изменяя поочередно степень окисления, может отдавать последовательно 4 электрона, которые далее восполняются за счет окисления двух молекул воды.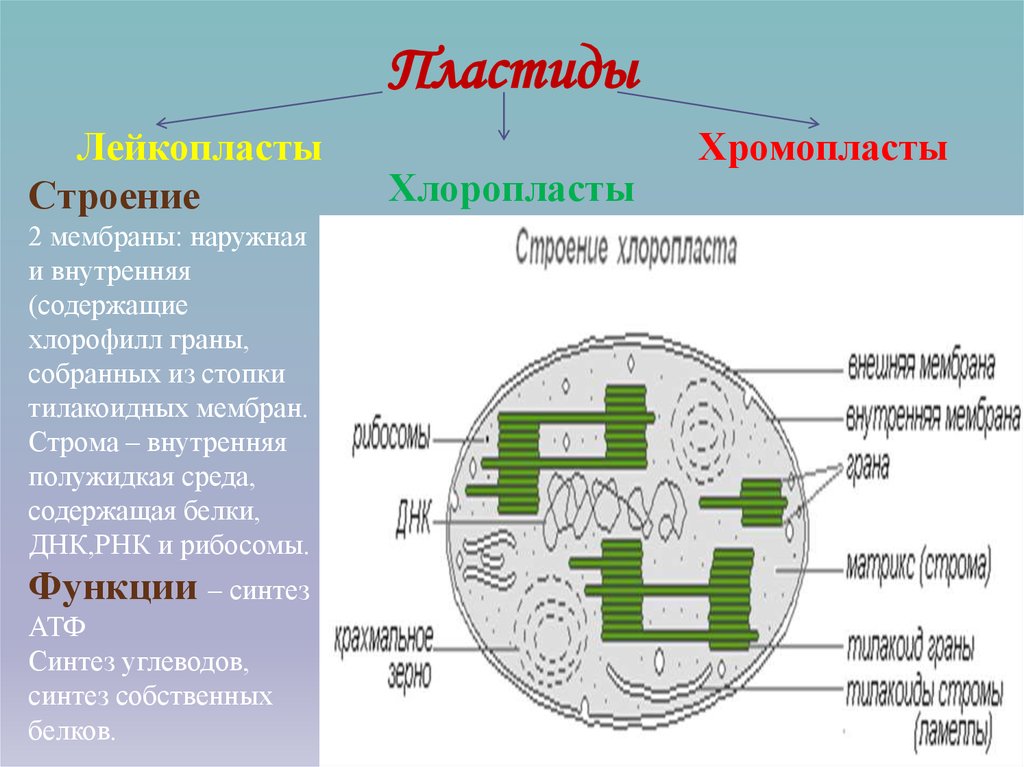
Марганцевый кластер располагается с люменальной стороны тилакоида, соединен с донорной частью ФСII. Обратите внимание, что в результате работы Mn-кластера в люмене также накапливаются протоны.
Вторая фотосистема (рис 20) состоит из множества белков – более 20, среди них есть белки, в которых непосредственно происходят фотохимические процессы (D1 и D2), комплексы внутренних и внешних антенн и большое количество других, необходимых для сборки, стабилизации, регулирования. Главный белок – D1, на нем происходят практически все основные события – разделение зарядов, формирование донорно-акцепторных пар. Структурно на него очень похож D2, с которым они находятся в димере. Р680 расположен на стыке между двумя этими белками, образуя связь с аминокислотами одного и второго. Всего реакционный центр ФС II несет 2 β-каротина, 2 феофитина, 6 хлорофиллов а.
На D1 и D2 есть похожие цепи электронных переносчиков, но функционирует только та, что на D1. С Р680* электрон передается на первичный акцептор – феофитин, с него на связанный хинон QA, с него на QB, который выходит в мембрану, в пул пластохинонов и далее может идти к цитохромному комплексу.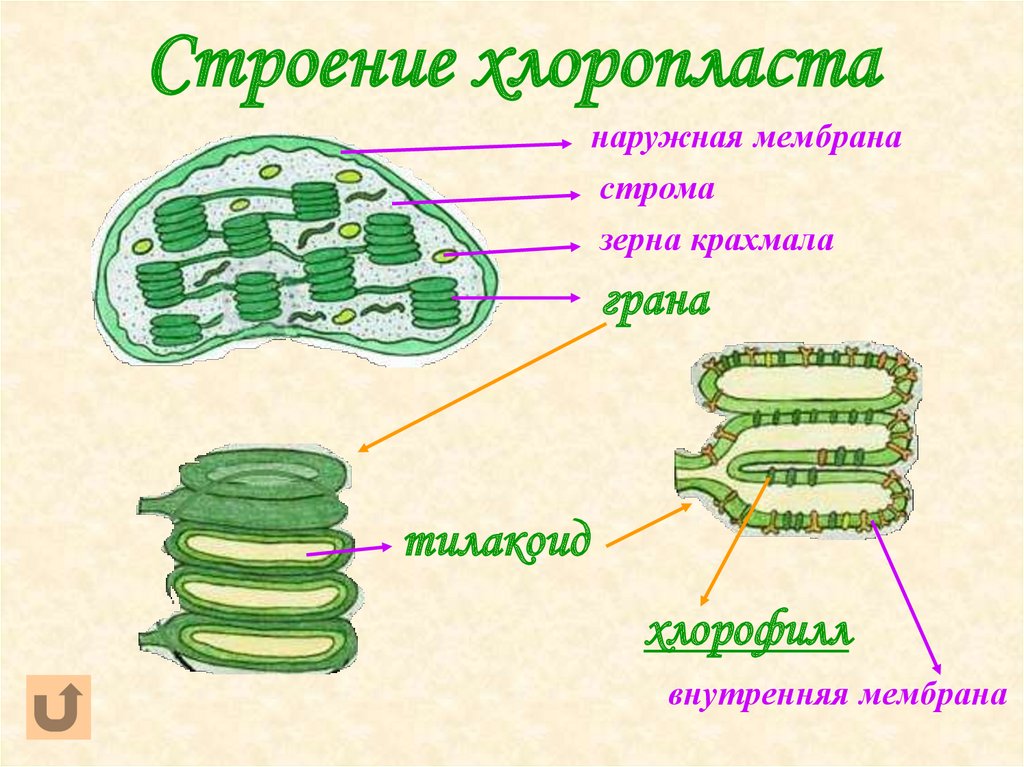
Забегая вперед, скажем про еще один (альтернативный) путь восстановления P680+. Он реализуется в том случае, если по каким-либо причинам перекрывается перенос электронов по ЭТЦ или нарушается работа водоокисляющего комплекса. В данном случае электрон с феофитина и/или с хинола поступает на цитохром b559, откуда далее идет к хлорофиллу ChlD и/или ChlZ и затем через каротин на P680+.
CP43 (=psbC) и CP47(=psbB) – внутренние светособирающие антенны фотосистемы. В них содержится несколько хлорофиллов а и β-каротины. CP29,26,24 (=Lhcb4,5,6) – внешние антенны, в них содержатся хлорофиллы а и b, лютеины, неоксантины и виолаксантины (которые превращаются в зеаксантин в виолаксантиновом цикле) . Также существует подвижный светособирающий комплекс (ССК II). Состоит из трех субъединиц (Lhcb1,2,3). При тусклой и нормальной освещенности ССК II находится рядом с ФСII, при избыточном освещении ССК II отходит и может присоединяться к ФС I.
Цитохром b6f в общем похож на митохондриальные и бактериальные bc1.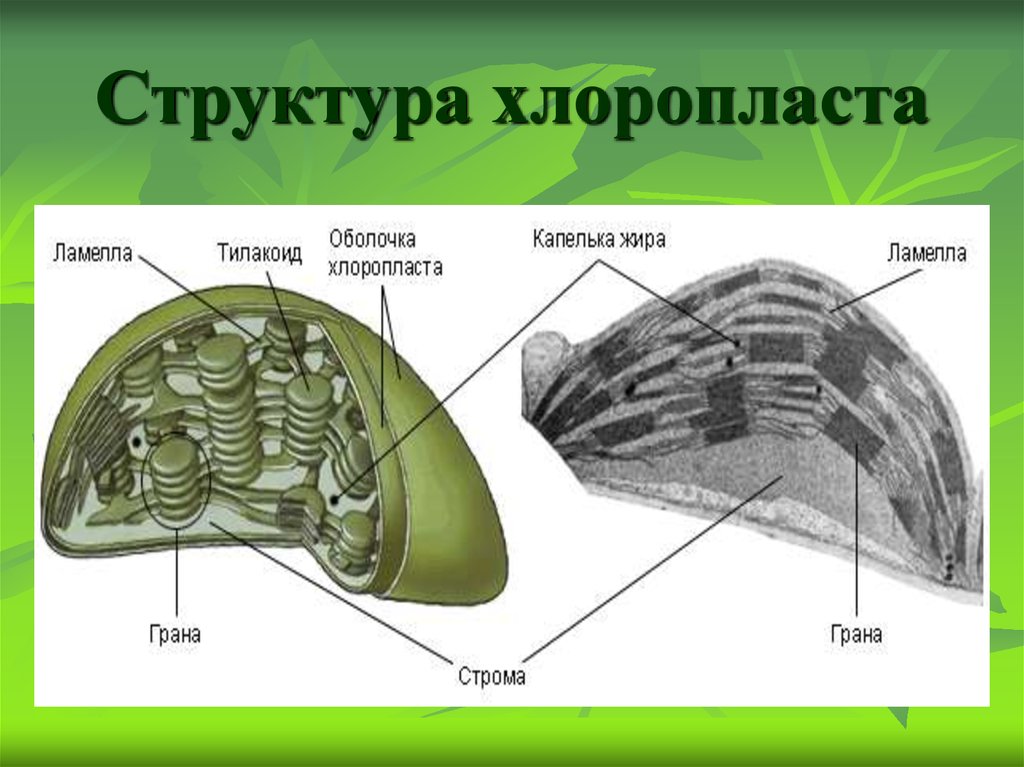 Это димерный комплекс, в котором есть два сайта связывания пластохинонов (Qp – со стороноы люмена, здесь окисляется пластохинол; Qn – со стороны стромы, в нем восстанавливается пластохинон). Также имеются цитохромы – низкопотенциальный bL и высокопотенциальный bH, цитохром f – связь с пластоцианином. Подробно прочитать про функционирование можно в Википедии, статья очень хорошо написана (https://ru.wikipedia.org/?oldid=94460479). Если коротко, то основные происходящие в комплексе процессы следующие. Пластохинол связывается в Qp сайте, окисляется, превращаясь в семихинон, при этом первый протон выходит в люмен. Первый электрон идет по так называемой высокопотенциальной ветви на белок Риске – 2Fe2S – содержащий белок, который, претерпевая конформационные изменения после акцептирования электрона, передает его на цитохром f. После передачи электрона на белок Риске этот путь временно перекрывается и следующий электрон уходит от семихинона, окисляя его до пластохинона (второй протон уходит в люмен), идет по цепи цитохромов – низкопотенциального и высокопотенциального, откуда сбрасывается на пластохинон, связанный в Qn сайте, восстанавливая его до семихинона (протон берется из стромы).
Это димерный комплекс, в котором есть два сайта связывания пластохинонов (Qp – со стороноы люмена, здесь окисляется пластохинол; Qn – со стороны стромы, в нем восстанавливается пластохинон). Также имеются цитохромы – низкопотенциальный bL и высокопотенциальный bH, цитохром f – связь с пластоцианином. Подробно прочитать про функционирование можно в Википедии, статья очень хорошо написана (https://ru.wikipedia.org/?oldid=94460479). Если коротко, то основные происходящие в комплексе процессы следующие. Пластохинол связывается в Qp сайте, окисляется, превращаясь в семихинон, при этом первый протон выходит в люмен. Первый электрон идет по так называемой высокопотенциальной ветви на белок Риске – 2Fe2S – содержащий белок, который, претерпевая конформационные изменения после акцептирования электрона, передает его на цитохром f. После передачи электрона на белок Риске этот путь временно перекрывается и следующий электрон уходит от семихинона, окисляя его до пластохинона (второй протон уходит в люмен), идет по цепи цитохромов – низкопотенциального и высокопотенциального, откуда сбрасывается на пластохинон, связанный в Qn сайте, восстанавливая его до семихинона (протон берется из стромы).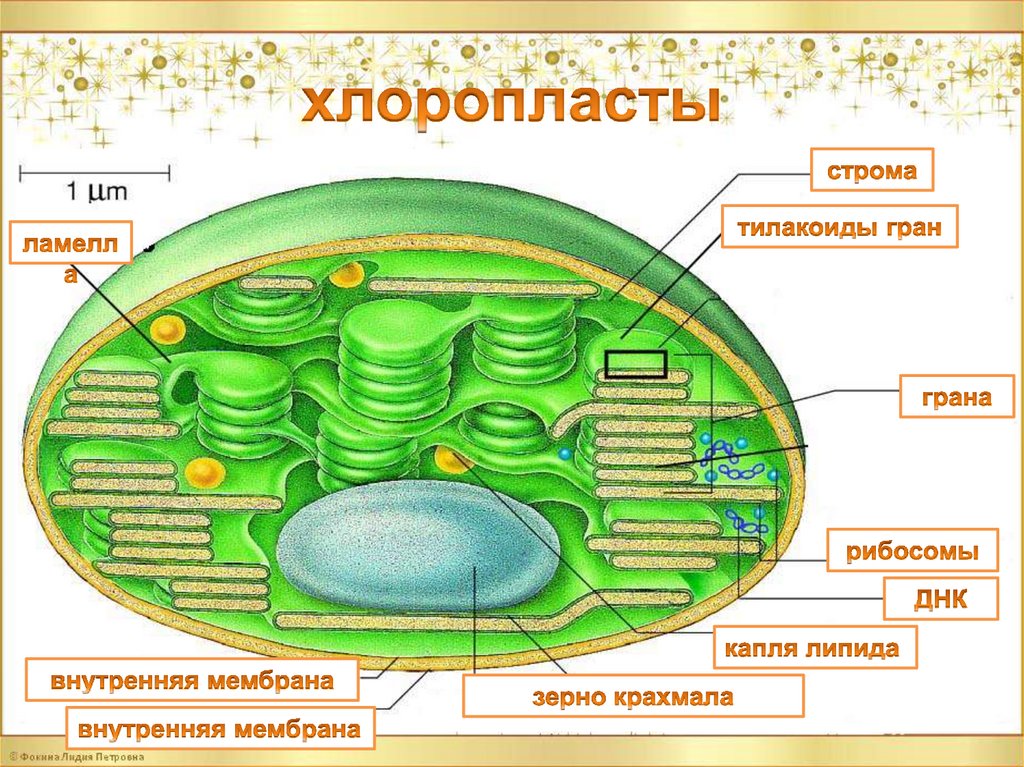 Из Qp пластохинон уходит обратно в мембрану и в Qp связывается следующий пластохинол. Снова повторяются описанные процессы окисления и переноса электронов, и уже в Qn – сайте семихинон восстанавливается до пластохинола, который может уйти в мембранный пул, а затем связаться в Qp сайте. Описанные процессы называются Q-циклом (рис. 23). Можно представить все в виде уравнения:
Из Qp пластохинон уходит обратно в мембрану и в Qp связывается следующий пластохинол. Снова повторяются описанные процессы окисления и переноса электронов, и уже в Qn – сайте семихинон восстанавливается до пластохинола, который может уйти в мембранный пул, а затем связаться в Qp сайте. Описанные процессы называются Q-циклом (рис. 23). Можно представить все в виде уравнения:
2Cytf3++2H++2PQh3+PQ +2e-2PQ+PQh3+4H++2Cytf2+
Сократив хиноны и хинолы, но не сокращая протоны, так как они по разные стороны от мембраны, получим:
2Cytf3++2H++PQh3 +2e-PQ+4H++2Cytf2+
Таким образом, если рассматривать процесс в динамике, получается, что на каждый пластохинол, окисленный в Qp сайте через мембрану переносится 4 протона и восстанавливается 2 цитохрома f. А цитохром f передает электрон на пластоцианин. Значит, на каждый окисленный пластохинол к первой фотосистеме приходит два электрона.
Пластоцианин, приняв электрон от цитохрома f, (Cu2+Pc + e− → Cu+Pc), перемещается в люменальном пространстве и передает e− на I фотосистему: Cu+Pc → Cu2+Pc + e−.
Первая фотосистема также является сложным белковым комплексом. Белки A (PsaA) и В (PsaB) образуют гетеродимер, содержащий реакционный центр и первичные акцепторы: Р700, А0, А1, Fx. Белок С содержит железо-серные кластеры (4Fe4S) FA, FB. Белки D, E образуют сайт связывания ферредоксина (Fd), F обуславливает связь с пластоцианином (PC). С ферредоксином связывается FNR – Fd:NADP+-редуктаза (содержит FAD – кофактор флавиновой природы), восстанавливается NADP+ до NADPH.
В первой фотосистеме, в отличие от второй, функционируют обе ветви транспорта, но, возможно, при разных условиях. Также есть вариант переноса на уровне железосерных кластеров.
Пигмент P700* — очень мощный восстановитель, его потенциала хватает, чтобы восстановить NADP+.
Первичным акцептором электрона является хлорофилл а695 (А0), далее электрон переходит на акцептор хинольной природы (филлохинон, витамин К1) и FeS кластеры.
У первой фотосистемы также есть свои антенны. Внутренние антенны располагаются непосредственно на белках А и B, содержат β-каротины и хлорофилл а.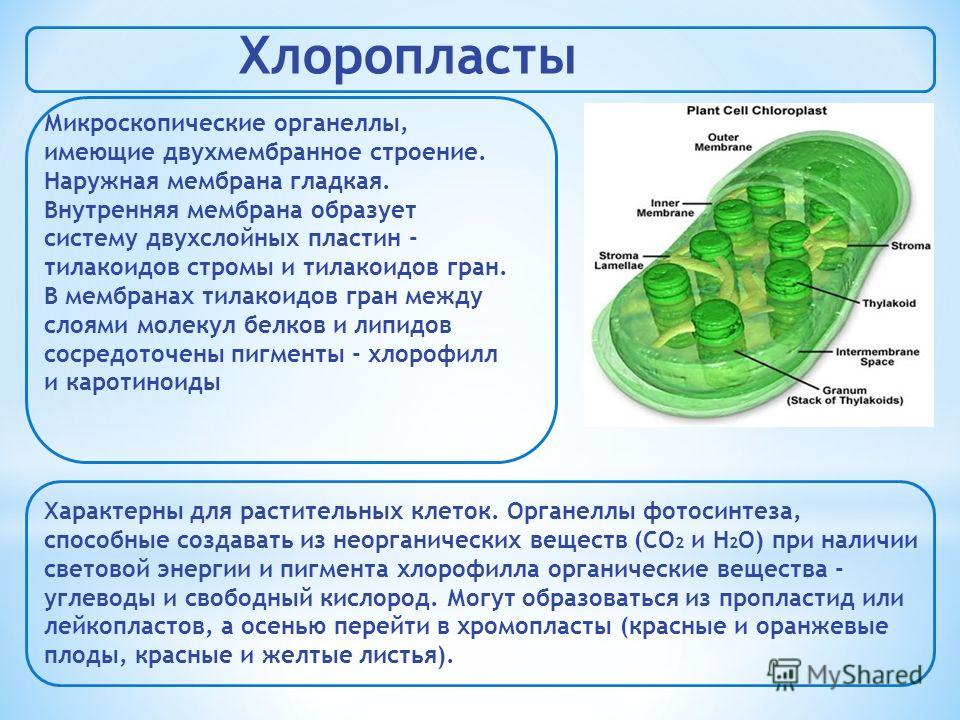 Внешние – Lhca1-4, несут хророфиллы а и b, каротин и ксантофиллы.
Внешние – Lhca1-4, несут хророфиллы а и b, каротин и ксантофиллы.
Ферредоксин растений содержит 2Fe2S кластер, относительно устойчив к кислороду.
Теперь немного поговорим о том, как может изменяться транспорт электронов, в зависимости от условий. На ЭТЦ влияет множество различных факторов, основные из которых: интенсивность освещения, доступность NADP+, величина протонного градиента, pH стромы и люмена.
На избыточном свету могут начинать происходить фотодеструктивные процессы. Прежде всего это связано с Р680. Если по каким-либо причинам транспорт электронов по ЭТЦ перекрывается, невозможность релаксировать возбужденное состояние P680* приведет к многочисленным, уже вкратце упоминавшимся негативным последствиям, в нейтрализации которых каротиноиды играют существенную роль. Еще вариант восстановления – замена D1 белка, который на ярком свету очень быстро разрушается.
Чтобы снизить риск возникновения фотодеструкции, существует ряд превентивных мер. Мы уже говорили об альтернативном транспорте вокруг ФС II – это одна из таких мер.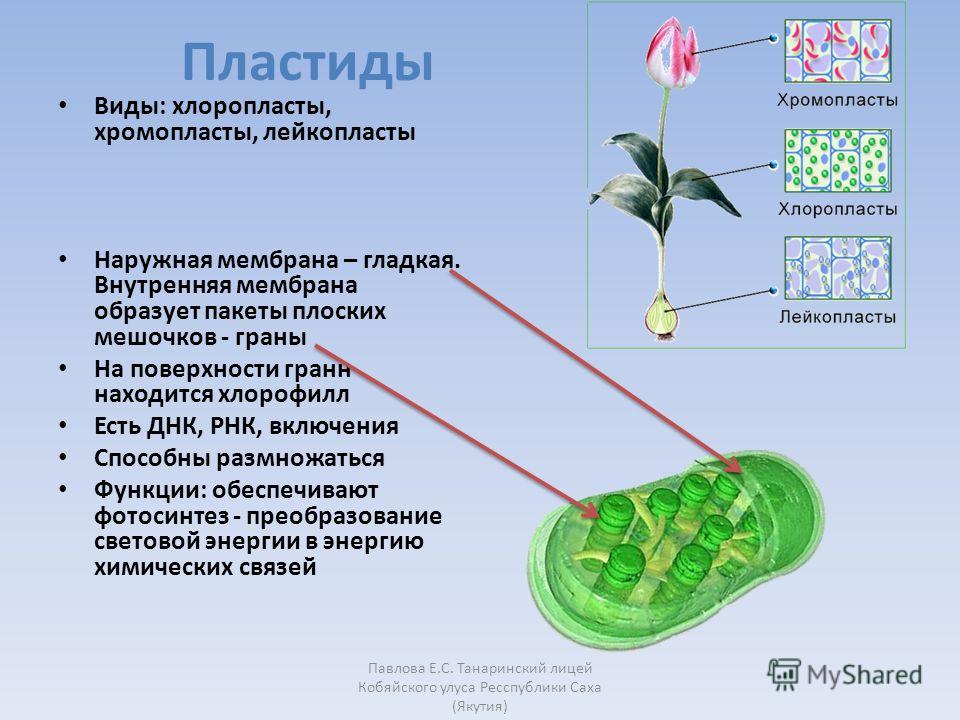
Также существует транспорт вокруг первой фотосистемы. ФС I более устойчива на ярком свету, чем ФСII, поэтому при избыточной интенсивности света происходит изменение антенных систем: ССКII отсоединяется от ФСII и присоединяется к ФСI. Это, с одной стороны, приводит к уменьшению притока энергии к Р860, а значит и уменьшает разрушение ФСII. С другой стороны, интенсифицирует приток энергии к Р700. В циклическом транспорте вокруг ФСI участвует новый фермент – ферредоксин-пластохинон оксидоредуктаза, таким образом, электроны с ферредоксина идут не на восстановление NADPH, а на восстановление пластохинонов. NADPH нет, но градиент протонов нагнетается, АТФ синтезируется (работает Q-цикл). Этот транспорт помогает как раз в том случае, когда из-за перевосстановленности пула NADP (нехватки NADP+) происходит торможение потока электронов по ЭТЦ, что может усилить их сброс на кислород с образованием активных форм кислорода. Как уже упоминали, переход ССК II связан с изменением мембранной структуры хлоропласт – разбираются граны. Дело в том, ч в хлоропластах каждый компонент ЭТЦ расположен в определенном месте тилакоидых мембран и мембран ламелл стромы. Из-за сильно выпирающей стромальной части первая фотосистема может располагаться только на ламеллах стромы и на внешних частях гран. ССК II участвуют в сборке гран, взаимодействуя с ССК II других тилакоидов, то есть располагаются на смежных мембранах внутри граны. Там же находится и вторая фотосистема. Именно из-за этого при перераспределении ССК II между тилакоидами граны и ламеллами происходит распад гран. Этот процесс обратим: при изменении интенсивности освещения или других условий граны вновь собираются.
Дело в том, ч в хлоропластах каждый компонент ЭТЦ расположен в определенном месте тилакоидых мембран и мембран ламелл стромы. Из-за сильно выпирающей стромальной части первая фотосистема может располагаться только на ламеллах стромы и на внешних частях гран. ССК II участвуют в сборке гран, взаимодействуя с ССК II других тилакоидов, то есть располагаются на смежных мембранах внутри граны. Там же находится и вторая фотосистема. Именно из-за этого при перераспределении ССК II между тилакоидами граны и ламеллами происходит распад гран. Этот процесс обратим: при изменении интенсивности освещения или других условий граны вновь собираются.
Другой альтернативный вариант, как можно разгрузить ЭТЦ – перенести электроны с ферредоксина на кислород с образованием суперокидрадикала. Это активная форма кислорода, но она может быстро нейтрализоваться до перекиси водорода (другая форма АФК) супероксиддисмутазой. А перекись водорода пероксидазой за счет окисления аскорбата (анион аскорбиновой кислоты) восстанавливается до кислорода и воды.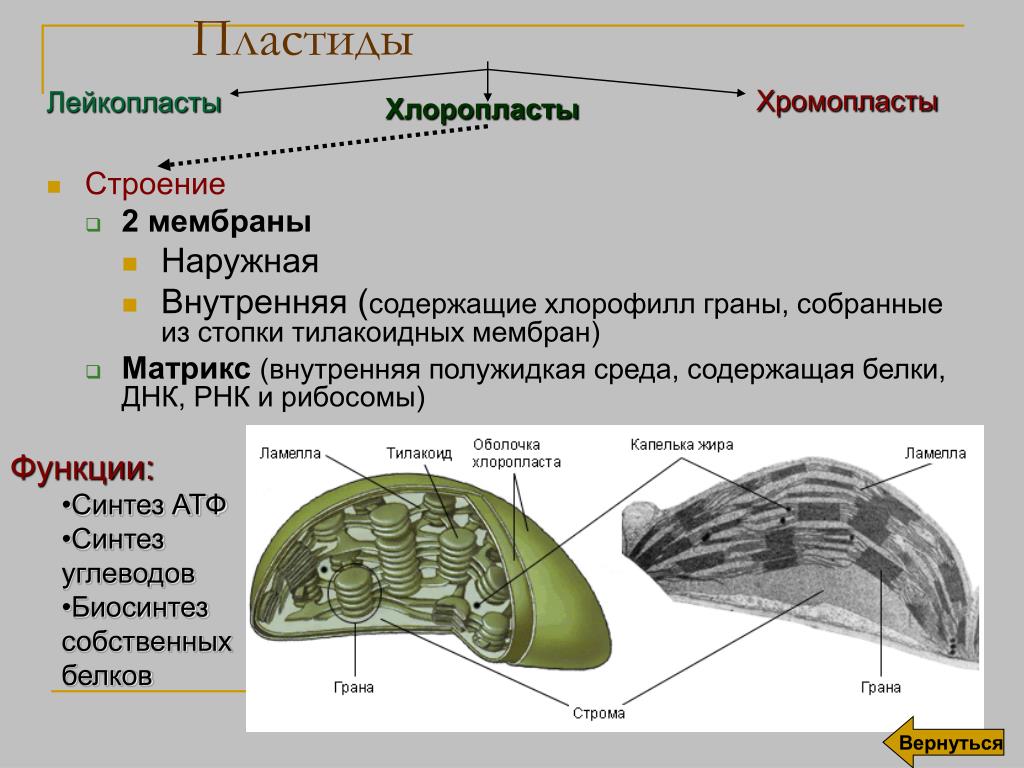 Другое название этого процесса – реакция Мелера.
Другое название этого процесса – реакция Мелера.
Существует еще один альтернативный путь – хлородыхание. В тилакоидной мембране присутствует NADPH-дегидрогеназа – фермент, окисляющий NADPH и передающий электроны на пластохиноны. Пластохиноны дальше могут окисляться на пластидной альтернативной оксидазе, в результате работы которой кислород восстанавливается до воды. Таким образом, в ходе фотосинтеза кислород не только выделяется, но и расходуется, при определенных условиях.
Вкратце рассмотрим еще один интересный механизм защиты СФ II от деструкции – виолаксантиновый цикл. Он проходит в антенных комплнксах, содержащих соответствующие ксантофиллы, при избыточной освещенности. Реакции и превращения изображены на рисунке 28. На пути виолаксантин-зеаксантин действует расположенная с люменальной стороны мембраны де-эпоксидаза, в обратном направлении – эпоксидаза, располагающаяся со стромальной стороны мембраны тилакоида. Ферменты регулируются состоянием pH. Де-эпоксидаза активируется при сильном закислении люмена (=стресс, избыточное освещение), то есть при создании довольно высокого протонного градиента, который, в свою очередь, тоже может тормозить ЭТЦ.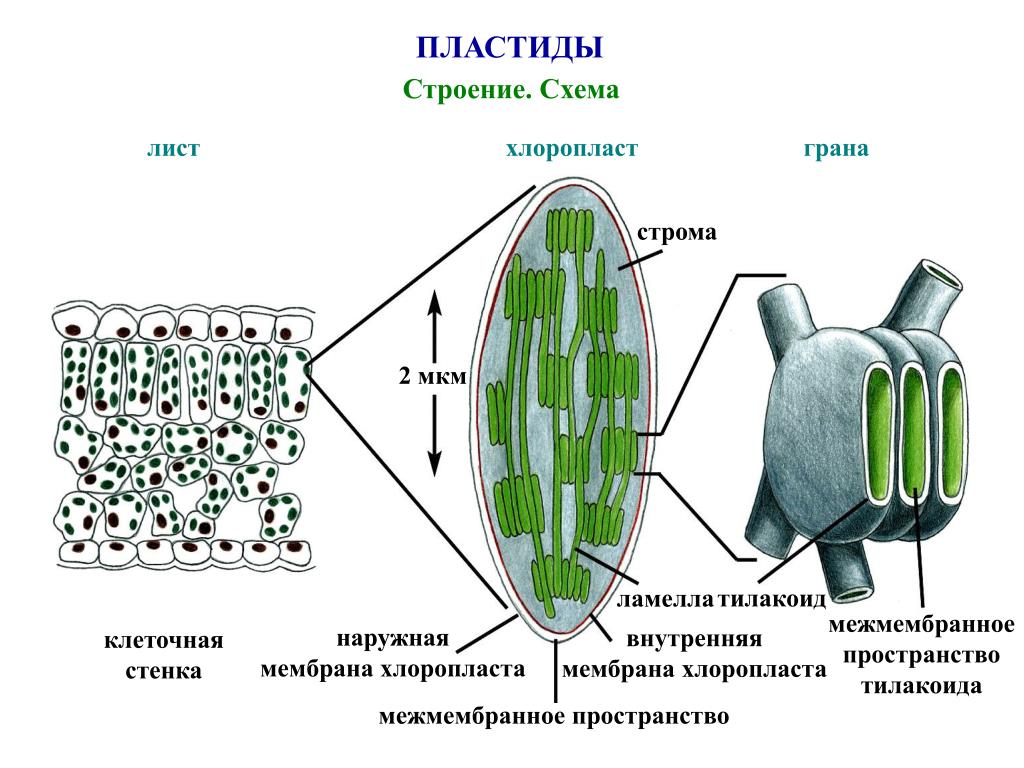 Конечным результатом реакции является изменение числа сопряженных двойных связей в ксантофилле, что влияет на его фотохимические свойства. На рисунке 29 показаны энергетические уровни (основные и возбужденные) виолаксантина, хлорофилла и зеаксантина, из соотношения которых видно, как может между ними переходить возбужденное состояние. Таким образом, виолаксантин работает как антенна и передает энергию на хлорофилл (при низкой освещенности), а зеаксантин выполняет защитную роль, забирая избыток энергии.
Конечным результатом реакции является изменение числа сопряженных двойных связей в ксантофилле, что влияет на его фотохимические свойства. На рисунке 29 показаны энергетические уровни (основные и возбужденные) виолаксантина, хлорофилла и зеаксантина, из соотношения которых видно, как может между ними переходить возбужденное состояние. Таким образом, виолаксантин работает как антенна и передает энергию на хлорофилл (при низкой освещенности), а зеаксантин выполняет защитную роль, забирая избыток энергии.
Приложения (Происхождение пластид, строение хлоропласта).
# Физиология растений
# 10 класс
# 11 класс
Хлоропласты и другие пластиды — Клетка
Хлоропласты, органеллы, ответственные за фотосинтез, во многом похожи на митохондрии. И хлоропласты, и митохондрии функционируют для выработки метаболической энергии, вырабатываемой эндосимбиозом, содержат свои собственные генетические системы и воспроизводятся путем деления.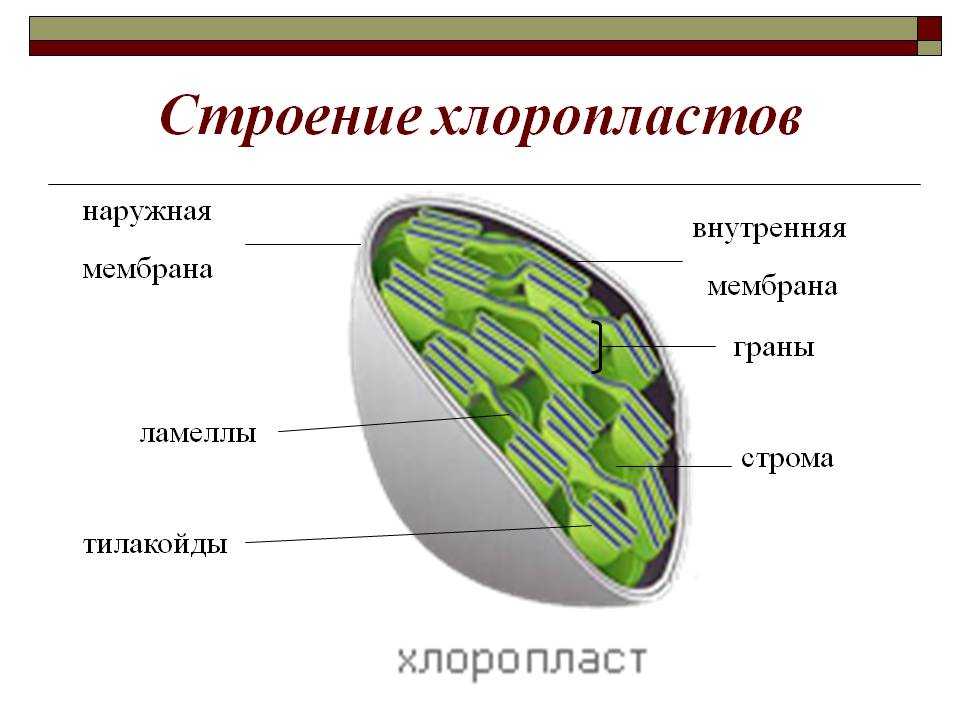 Однако хлоропласты крупнее и сложнее, чем митохондрии, и помимо образования АТФ они выполняют несколько важных задач. Самое главное, хлоропласты ответственны за фотосинтетическую конверсию CO 2 к углеводам. Кроме того, хлоропласты синтезируют аминокислоты, жирные кислоты и липидные компоненты собственных мембран. Восстановление нитрита (NO 2 — ) до аммиака (NH 3 ), важная стадия включения азота в органические соединения, также происходит в хлоропластах. Более того, хлоропласты являются лишь одним из нескольких типов родственных органелл (пластид), играющих разнообразные роли в растительных клетках.
Однако хлоропласты крупнее и сложнее, чем митохондрии, и помимо образования АТФ они выполняют несколько важных задач. Самое главное, хлоропласты ответственны за фотосинтетическую конверсию CO 2 к углеводам. Кроме того, хлоропласты синтезируют аминокислоты, жирные кислоты и липидные компоненты собственных мембран. Восстановление нитрита (NO 2 — ) до аммиака (NH 3 ), важная стадия включения азота в органические соединения, также происходит в хлоропластах. Более того, хлоропласты являются лишь одним из нескольких типов родственных органелл (пластид), играющих разнообразные роли в растительных клетках.
Структура и функция хлоропластов
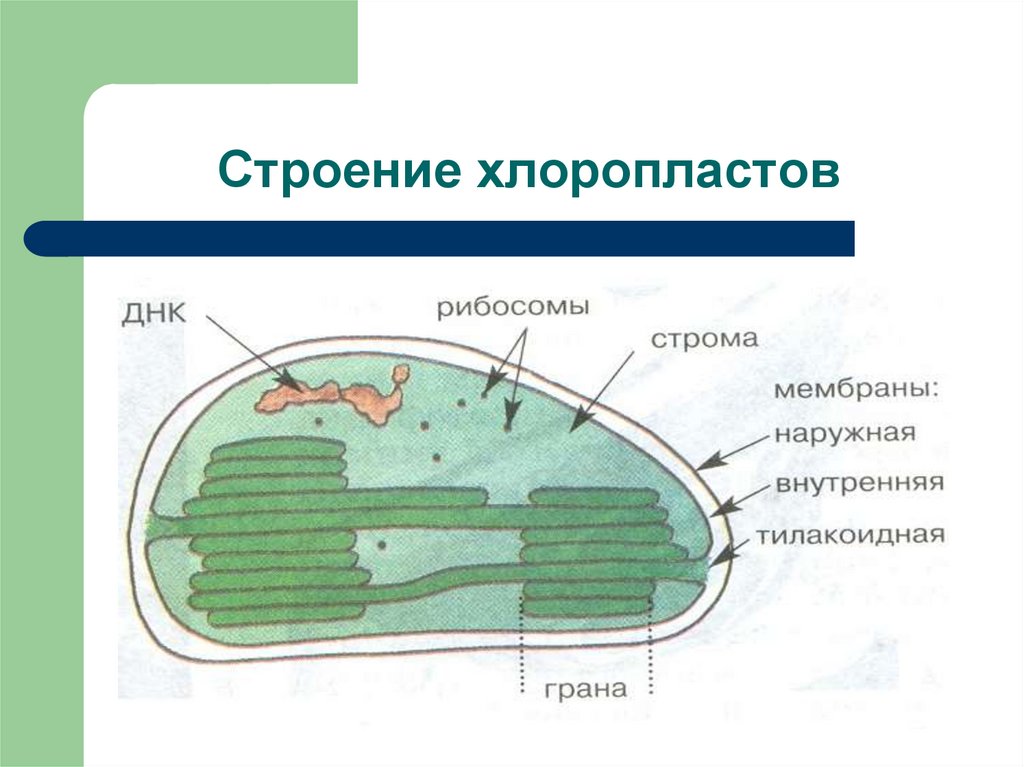
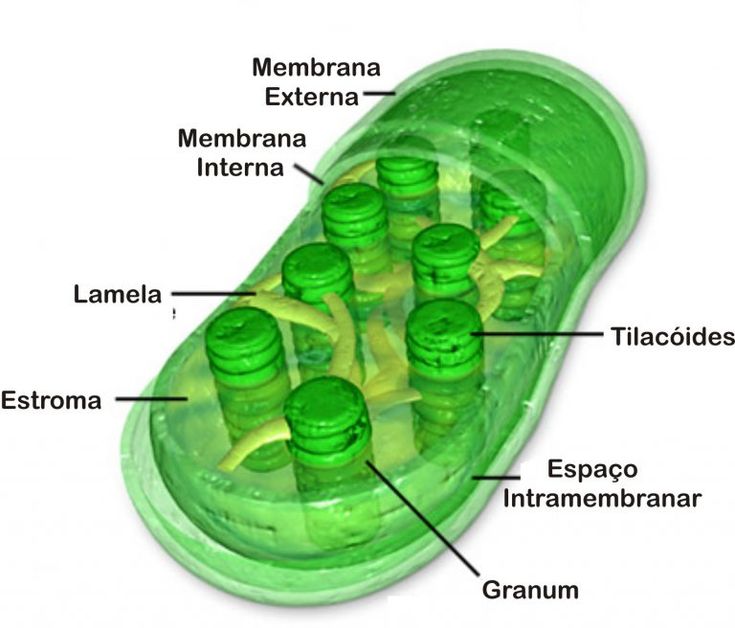
Хлоропласты растений представляют собой крупные органеллы (длиной от 5 до 10 мкм), которые, как и митохондрии, ограничены двойной мембраной, называемой оболочкой хлоропласта (). В дополнение к внутренней и внешней мембранам оболочки хлоропласты имеют третью внутреннюю мембранную систему, называемую тилакоидной мембраной.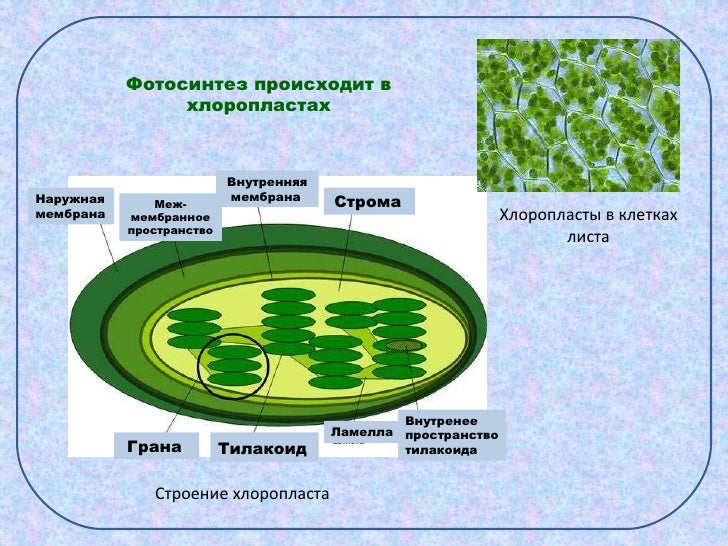
Рисунок 10.13
Строение хлоропласта. В дополнение к внутренней и внешней мембранам оболочки хлоропласты содержат третью внутреннюю мембранную систему: тилакоидную мембрану. Эти мембраны делят хлоропласты на три внутренних отсека. (Электронная микрофотография (подробнее…)
Несмотря на большую сложность, мембраны хлоропластов имеют явное функциональное сходство с мембранами митохондрий — как и ожидалось, учитывая роль обеих органелл в хемиосмотическом образовании АТФ.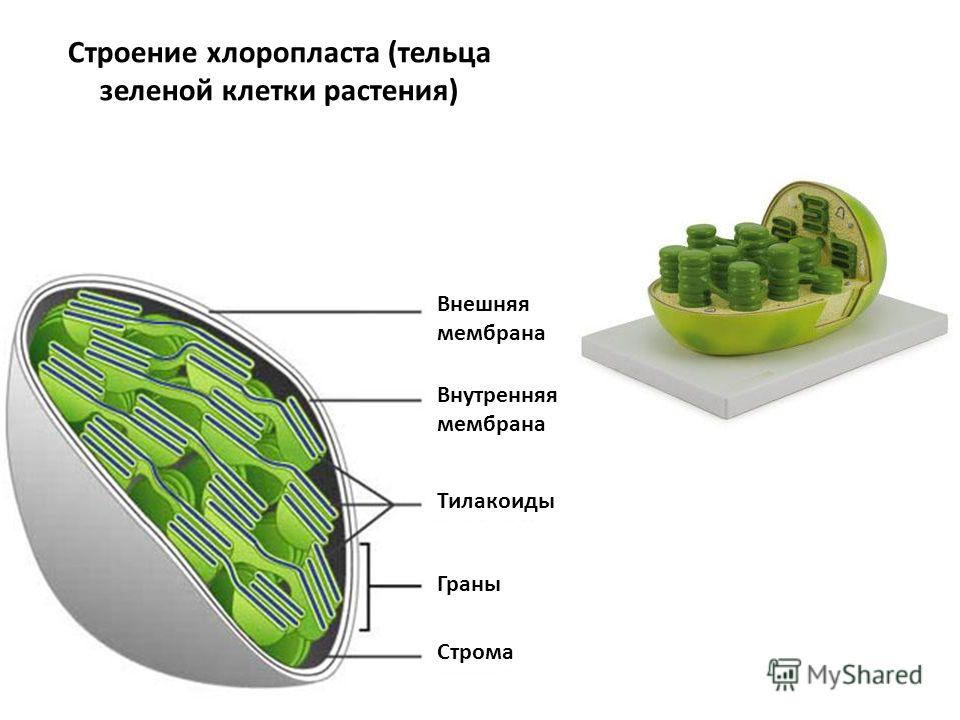 оболочка хлоропластов, как и оболочка митохондрий, содержит порины и поэтому свободно проницаема для небольших молекул, в то время как внутренняя мембрана непроницаема для ионов и метаболитов, поэтому они могут проникать в хлоропласты только через специфические мембранные переносчики. и наружные мембраны оболочки хлоропласта сходны с внутренней и наружной мембранами митохондрий: в обоих случаях внутренняя мембрана ограничивает прохождение молекул между цитозолем и внутренней частью органеллы Строма хлоропласта также по функциям эквивалентна митохондриальной матрикс: он содержит генетическую систему хлоропластов и множество метаболических ферментов, в том числе отвечает за критическую конверсию CO 2 к углеводам при фотосинтезе.
оболочка хлоропластов, как и оболочка митохондрий, содержит порины и поэтому свободно проницаема для небольших молекул, в то время как внутренняя мембрана непроницаема для ионов и метаболитов, поэтому они могут проникать в хлоропласты только через специфические мембранные переносчики. и наружные мембраны оболочки хлоропласта сходны с внутренней и наружной мембранами митохондрий: в обоих случаях внутренняя мембрана ограничивает прохождение молекул между цитозолем и внутренней частью органеллы Строма хлоропласта также по функциям эквивалентна митохондриальной матрикс: он содержит генетическую систему хлоропластов и множество метаболических ферментов, в том числе отвечает за критическую конверсию CO 2 к углеводам при фотосинтезе.
Основное различие между хлоропластами и митохондриями с точки зрения как структуры, так и функции заключается в тилакоидной мембране. Эта мембрана имеет центральное значение в хлоропластах, где она выполняет роль внутренней митохондриальной мембраны в транспорте электронов и хемиосмотическом образовании АТФ (10). Внутренняя мембрана оболочки хлоропластов (не свернутая в кристы) не участвует в фотосинтезе. Вместо этого хлоропластная система переноса электронов расположена в мембране тилакоидов, и протоны перекачиваются через эту мембрану из стромы в просвет тилакоидов. Результирующий электрохимический градиент затем запускает синтез АТФ по мере того, как протоны возвращаются в строму. Таким образом, по своей роли в генерации метаболической энергии тилакоидная мембрана хлоропластов эквивалентна внутренней мембране митохондрий.
Внутренняя мембрана оболочки хлоропластов (не свернутая в кристы) не участвует в фотосинтезе. Вместо этого хлоропластная система переноса электронов расположена в мембране тилакоидов, и протоны перекачиваются через эту мембрану из стромы в просвет тилакоидов. Результирующий электрохимический градиент затем запускает синтез АТФ по мере того, как протоны возвращаются в строму. Таким образом, по своей роли в генерации метаболической энергии тилакоидная мембрана хлоропластов эквивалентна внутренней мембране митохондрий.
Рисунок 10.14
Хемиосмотическое образование АТФ в хлоропластах и митохондриях. В митохондриях транспорт электронов создает протонный градиент через внутреннюю мембрану, который затем используется для запуска синтеза АТФ в матриксе. В хлоропластах градиент протонов составляет (подробнее…)
Геном хлоропластов
Подобно митохондриям, хлоропласты содержат собственную генетическую систему, отражающую их эволюционное происхождение от фотосинтезирующих бактерий.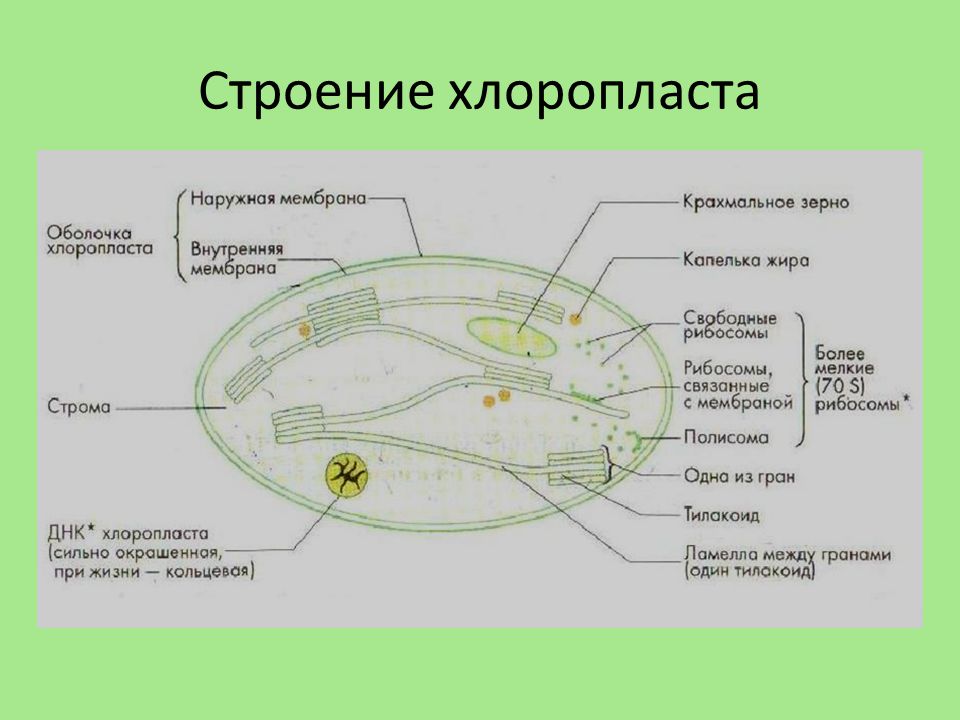 Геномы хлоропластов сходны с геномами митохондрий тем, что они состоят из кольцевых молекул ДНК, присутствующих во множестве копий на органеллу. Однако геномы хлоропластов крупнее и сложнее, чем геномы митохондрий, размером от 120 до 160 т.п.н. и содержат примерно 120 генов.
Геномы хлоропластов сходны с геномами митохондрий тем, что они состоят из кольцевых молекул ДНК, присутствующих во множестве копий на органеллу. Однако геномы хлоропластов крупнее и сложнее, чем геномы митохондрий, размером от 120 до 160 т.п.н. и содержат примерно 120 генов.
Геномы хлоропластов нескольких растений были полностью секвенированы, что привело к идентификации многих генов, содержащихся в ДНК органелл. Эти хлоропластные гены кодируют как РНК, так и белки, участвующие в экспрессии генов, а также различные белки, участвующие в фотосинтезе. Как рибосомные, так и транспортные РНК, используемые для трансляции мРНК хлоропластов, кодируются геномом органеллы. К ним относятся четыре рРНК (23S, 16S, 5S и 4,5S) и 30 видов тРНК. В отличие от меньшего числа тРНК, кодируемых митохондриальным геномом, хлоропластных тРНК достаточно для трансляции всех кодонов мРНК в соответствии с универсальным генетическим кодом. Помимо этих РНК-компонентов системы трансляции, геном хлоропластов кодирует около 20 рибосомных белков, которые составляют примерно треть белков рибосом хлоропластов.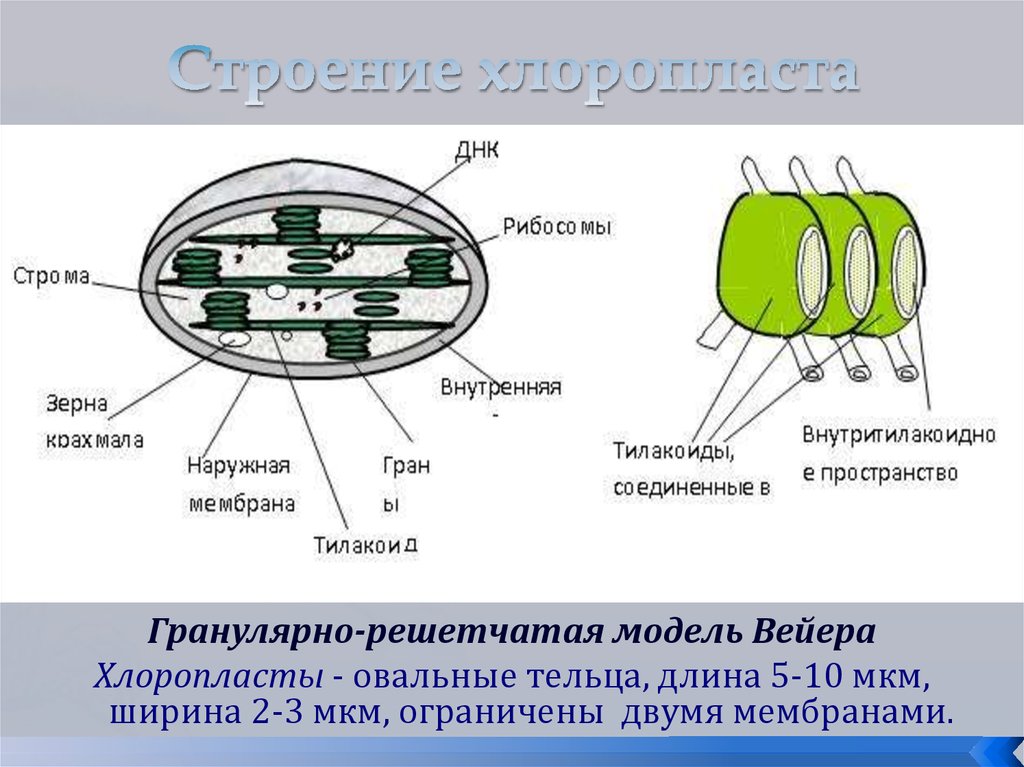 Некоторые субъединицы РНК-полимеразы также кодируются хлоропластами, хотя дополнительные субъединицы РНК-полимеразы и другие факторы, необходимые для экспрессии генов хлоропластов, кодируются в ядре.
Некоторые субъединицы РНК-полимеразы также кодируются хлоропластами, хотя дополнительные субъединицы РНК-полимеразы и другие факторы, необходимые для экспрессии генов хлоропластов, кодируются в ядре.
Таблица 10.2
Гены, кодируемые хлоропластной ДНК.
Геном хлоропластов также кодирует около 30 белков, участвующих в фотосинтезе, включая компоненты фотосистем I и II, комплекса цитохрома bf и АТФ-синтазы. Кроме того, одна из субъединиц рибулозобисфосфаткарбоксилазы (rubisco) кодируется хлоропластной ДНК. Рубиско является критическим ферментом, который катализирует присоединение CO 2 к рибулозо-1,5-бисфосфату во время цикла Кальвина (см. ). Он не только является основным белковым компонентом стромы хлоропластов, но и считается самым распространенным белком на Земле, поэтому примечательно, что одна из его субъединиц кодируется хлоропластным геномом.
Импорт и сортировка белков хлоропластов
Хотя хлоропласты кодируют больше собственных белков, чем митохондрии, около 90% белков хлоропластов по-прежнему кодируются ядерными генами.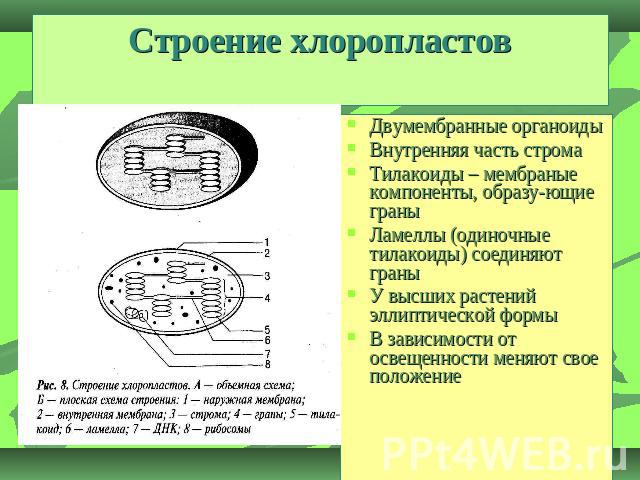 Как и в случае с митохондриями, эти белки синтезируются на цитозольных рибосомах, а затем импортируются в хлоропласты в виде завершенных полипептидных цепей. Затем они должны быть отсортированы по соответствующему месту внутри хлоропластов — задача даже более сложная, чем сортировка белков в митохондриях, поскольку хлоропласты содержат три отдельные мембраны, которые делят их на три отдельных внутренних компартмента.
Как и в случае с митохондриями, эти белки синтезируются на цитозольных рибосомах, а затем импортируются в хлоропласты в виде завершенных полипептидных цепей. Затем они должны быть отсортированы по соответствующему месту внутри хлоропластов — задача даже более сложная, чем сортировка белков в митохондриях, поскольку хлоропласты содержат три отдельные мембраны, которые делят их на три отдельных внутренних компартмента.
Импорт белка в хлоропласты обычно напоминает импорт митохондриального белка (). Белки предназначены для импорта в хлоропласты с помощью N-концевых последовательностей от 30 до 100 аминокислот, называемых транзитными пептидами , которые направляют транслокацию белка через две мембраны оболочки хлоропласта и затем удаляются протеолитическим расщеплением. Транзитные пептиды распознаются транслокационным комплексом внешнего члена хлоропласта (Toc-комплекс), и белки транспортируются через этот комплекс через мембрану. Затем они переносятся в транслокационный комплекс внутренней мембраны (комплекс Tic) и транспортируются через внутреннюю мембрану в строму.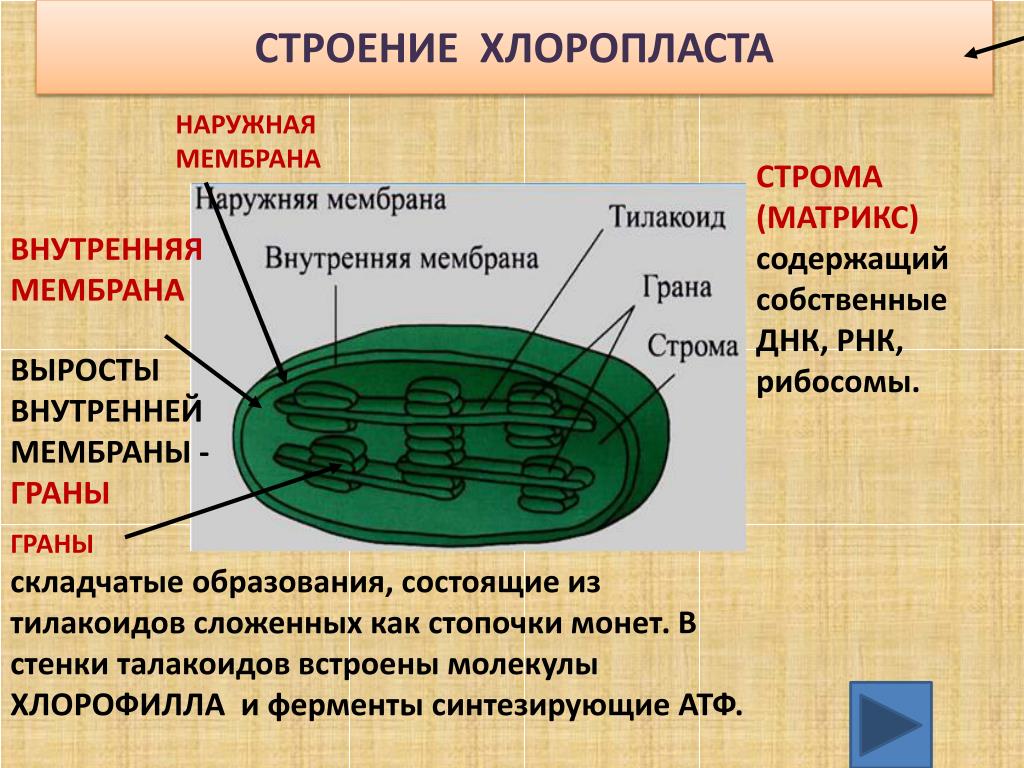 Как и в митохондриях, молекулярные шапероны как на цитозольной, так и на стромальной сторонах оболочки необходимы для импорта белка, что требует энергии в виде АТФ. Однако, в отличие от предварительных последовательностей митохондриального импорта, транзитные пептиды не заряжены положительно, и транслокация полипептидных цепей в хлоропласты не требует наличия электрического потенциала через мембрану.
Как и в митохондриях, молекулярные шапероны как на цитозольной, так и на стромальной сторонах оболочки необходимы для импорта белка, что требует энергии в виде АТФ. Однако, в отличие от предварительных последовательностей митохондриального импорта, транзитные пептиды не заряжены положительно, и транслокация полипептидных цепей в хлоропласты не требует наличия электрического потенциала через мембрану.
Рисунок 10.15
Импорт белка в строму хлоропласта. Белки предназначены для импорта в хлоропласты с помощью транзитного пептида на их амино-конце. Транзитный пептид направляет транслокацию полипептида через комплекс Toc во внешней мембране хлоропласта (подробнее…)
Белки, включенные в просвет тилакоидов, транспортируются к месту назначения в два этапа (). Сначала они импортируются в строму, как уже описано, а затем становятся мишенями для транслокации через тилакоидную мембрану с помощью второй гидрофобной сигнальной последовательности, которая экспонируется после расщепления транзитного пептида.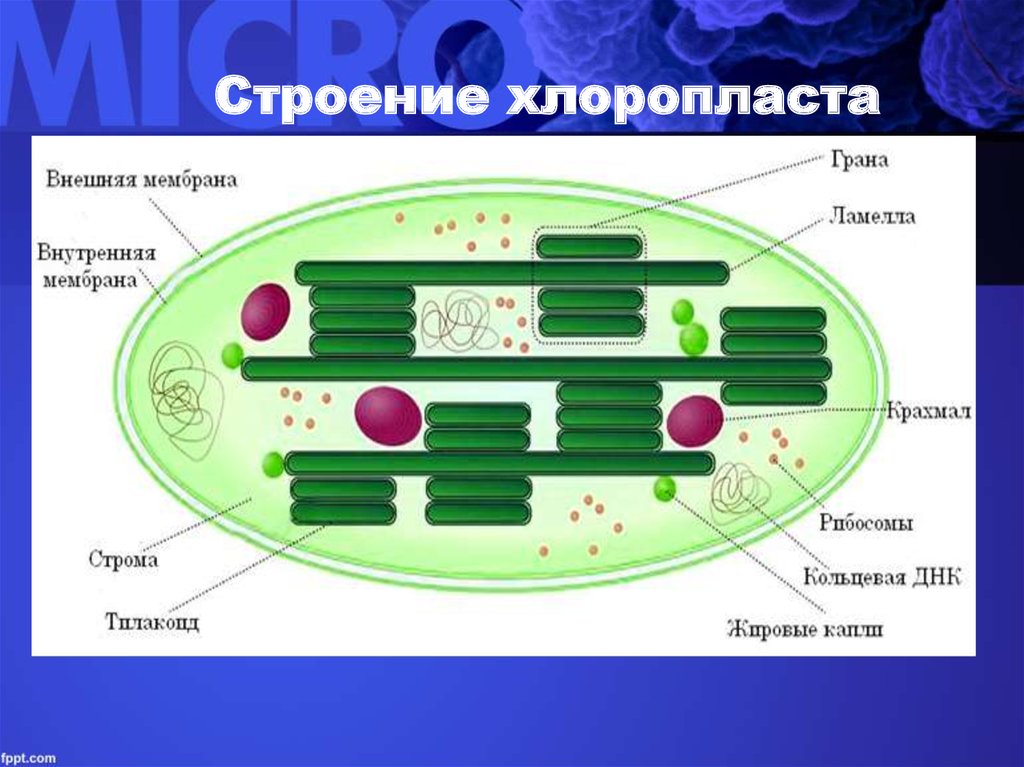 Гидрофобная сигнальная последовательность направляет транслокацию полипептида через тилакоидную мембрану и, наконец, удаляется вторым протеолитическим расщеплением внутри просвета.
Гидрофобная сигнальная последовательность направляет транслокацию полипептида через тилакоидную мембрану и, наконец, удаляется вторым протеолитическим расщеплением внутри просвета.
Рисунок 10.16
Импорт белков в просвет тилакоидов. Белки импортируются в просвет тилакоидов в два этапа. Первым шагом является импорт в строму хлоропласта, как показано на рис. 10.15. Затем расщепление транзитного пептида обнажает второй гидрофобный (подробнее…)
Пути сортировки белков в другие четыре компартмента хлоропластов — внутреннюю и внешнюю мембраны, тилакоидную мембрану и межмембранное пространство — изучены менее четко. Как и в случае с митохондриями, белки, по-видимому, встроены непосредственно во внешнюю мембрану оболочки хлоропласта. Напротив, белки, предназначенные либо для тилакоидной мембраны, либо для внутренней мембраны оболочки хлоропласта, изначально становятся мишенями для импорта в строму с помощью N-концевых транзитных пептидов. После расщепления транзитных пептидов эти белки становятся мишенями для встраивания в соответствующую мембрану с помощью других последовательностей, которые еще недостаточно охарактеризованы.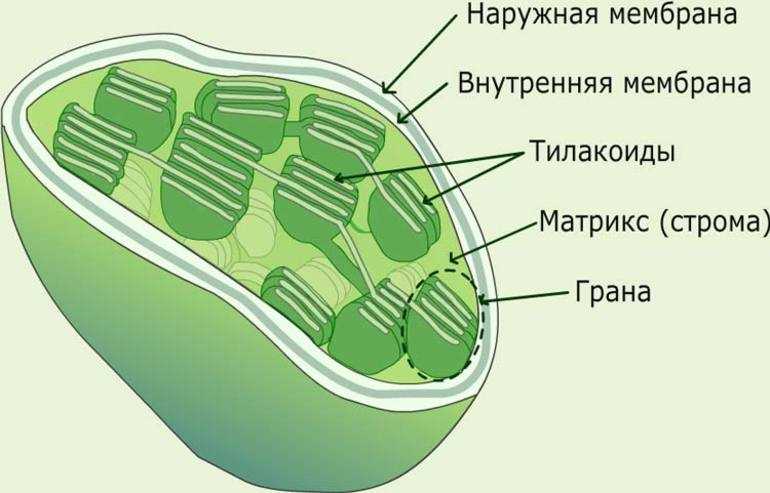 Наконец, не были идентифицированы ни последовательности, которые направляют белки в межмембранное пространство, ни пути, по которым они перемещаются к этому месту назначения.
Наконец, не были идентифицированы ни последовательности, которые направляют белки в межмембранное пространство, ни пути, по которым они перемещаются к этому месту назначения.
Другие пластиды
Хлоропласты являются лишь одним, хотя и наиболее заметным, членом большого семейства растительных органелл, называемых пластидами. Все пластиды содержат тот же геном, что и хлоропласты, но различаются как по структуре, так и по функциям. Хлоропласты специализируются на фотосинтезе и уникальны тем, что содержат внутреннюю тилакоидную мембранную систему. Другие пластиды, участвующие в различных аспектах метаболизма растительных клеток, ограничены двумя мембранами пластидной оболочки, но лишены как тилакоидных мембран, так и других компонентов фотосинтетического аппарата.
Различные типы пластид часто классифицируют по типам содержащихся в них пигментов. Хлоропласты названы так потому, что содержат хлорофилл. Хромопласты () лишены хлорофилла, но содержат каротиноиды; они ответственны за желтую, оранжевую и красную окраску некоторых цветов и фруктов, хотя их точная роль в клеточном метаболизме не ясна.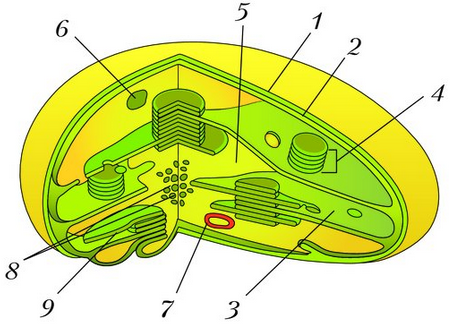 Лейкопласты представляют собой непигментированные пластиды, которые хранят различные источники энергии в нефотосинтезирующих тканях. Амилопласты () и элайопласты являются примерами лейкопластов, которые запасают крахмал и липиды соответственно.
Лейкопласты представляют собой непигментированные пластиды, которые хранят различные источники энергии в нефотосинтезирующих тканях. Амилопласты () и элайопласты являются примерами лейкопластов, которые запасают крахмал и липиды соответственно.
Рисунок 10.17
Электронные микрофотографии хромопластов и амилопластов. (A) Хромопласты содержат липидные капли, в которых хранятся каротиноиды. (B) Амилопласты содержат крупные гранулы крахмала. (A, Biophoto Associates/Photo Researchers, Inc.; B, Dr. Jeremy Burgess/Photo (подробнее…)
Все пластиды, включая хлоропласты, развиваются из пропластид , мелкие (от 0,5 до 1 мкм в диаметре) недифференцированные органеллы, присутствующие в быстро делящихся клетках корней и побегов растений. Затем пропластиды развиваются в различные типы зрелых пластид в соответствии с потребностями дифференцированных клеток. Кроме того, зрелые пластиды способны переходить из одного типа в другой. Хромопласты развиваются из хлоропластов, например, при созревании плодов (например, томатов). В ходе этого процесса хлорофилл и мембраны тилакоидов разрушаются, а синтезируются новые типы каротиноидов.
В ходе этого процесса хлорофилл и мембраны тилакоидов разрушаются, а синтезируются новые типы каротиноидов.
Интересной особенностью пластид является то, что их развитие контролируется как сигналами окружающей среды, так и внутренними программами дифференцировки клеток. В фотосинтезирующих клетках листьев, например, пропластиды развиваются в хлоропласты (). В ходе этого процесса тилакоидная мембрана формируется везикулами, отпочковывающимися от внутренней мембраны пластидной оболочки, и синтезируются и собираются различные компоненты фотосинтетического аппарата. Однако хлоропласты развиваются только в присутствии света. Если растения содержатся в темноте, развитие пропластид в листьях останавливается на промежуточной стадии (называемой этиопластов ), в которых сформировался полукристаллический массив трубчатых внутренних мембран, но хлорофилл не синтезировался (). Если затем выращенные в темноте растения выставить на свет, этиопласты продолжают свое развитие до хлоропластов.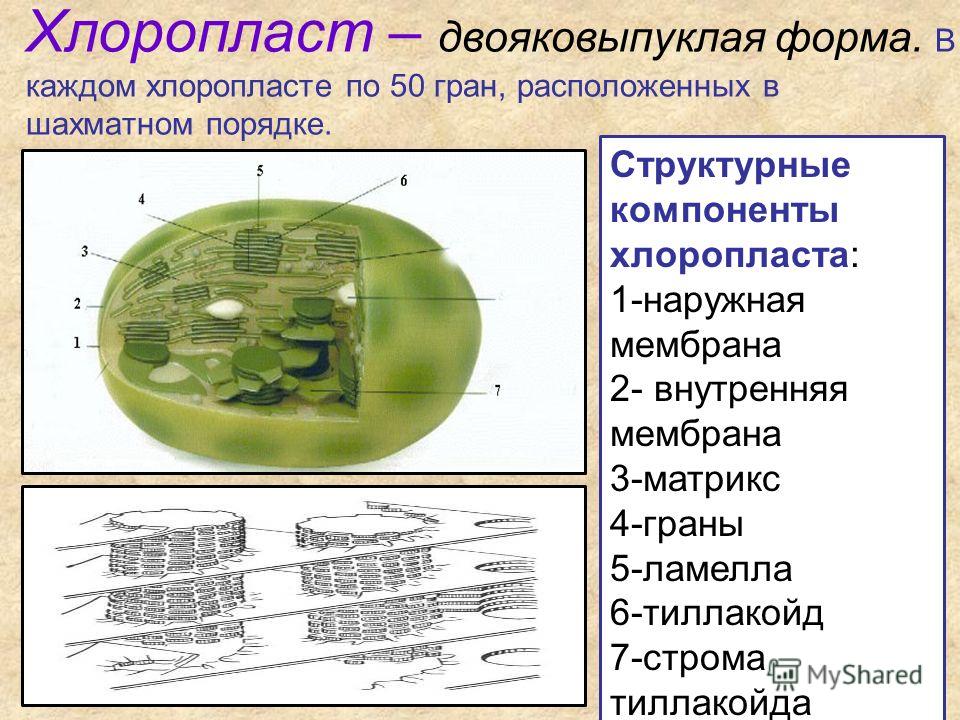 Примечательно, что этот двойной контроль развития пластид включает скоординированную экспрессию генов как в пластидном, так и в ядерном геномах. Механизмы, ответственные за такую скоординированную экспрессию генов, в значительной степени неизвестны, и их выяснение представляет собой сложную проблему в молекулярной биологии растений.
Примечательно, что этот двойной контроль развития пластид включает скоординированную экспрессию генов как в пластидном, так и в ядерном геномах. Механизмы, ответственные за такую скоординированную экспрессию генов, в значительной степени неизвестны, и их выяснение представляет собой сложную проблему в молекулярной биологии растений.
Рисунок 10.18
Развитие хлоропластов. Хлоропласты развиваются из пропластид в фотосинтезирующих клетках листьев. Пропластиды содержат только внутреннюю и внешнюю оболочечные мембраны; тилакоидная мембрана образуется путем отпочкования везикул от внутренней мембраны в процессе (подробнее…)
Рисунок 10.19
Электронная микрофотография этиопласта. (John N. A. Lott/Biological Photo Service.)
Хлоропласты – структура и функции
Присоединяйся сейчас
Если вы готовы сдать экзамены по биологии уровня A, станьте участником прямо сейчас, чтобы получить полный доступ ко всей нашей библиотеке материалов для повторения.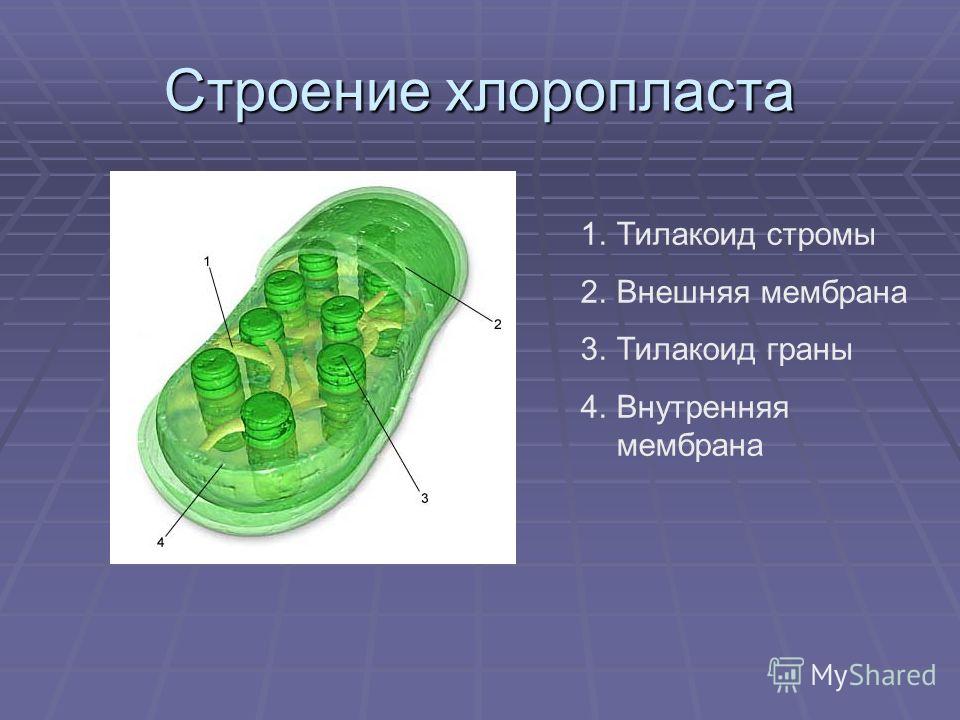
Присоединяйтесь к более чем 22 000 учащихся, сдавших экзамены благодаря нам!
Зарегистрируйтесь ниже, чтобы получить мгновенный доступ!
Присоединиться →
Или попробуйте пример…
Еще не готовы приобрести комплект для доработки? Без проблем. Если вы хотите ознакомиться с тем, что мы предлагаем, перед покупкой, у нас есть бесплатная подписка с образцами материалов для пересмотра.
Зарегистрируйтесь в качестве бесплатного члена ниже, и вы вернетесь на эту страницу, чтобы попробовать образцы материалов перед покупкой.
Скачать образцы →
Quick Navigation
[скрыть]
Хлоропласты являются местом фотосинтеза в эукариотических клетках. Они присутствуют только в фотосинтезирующих клетках, таких как клетки растений и водорослей. В клетках животных и бактерий нет хлоропластов.
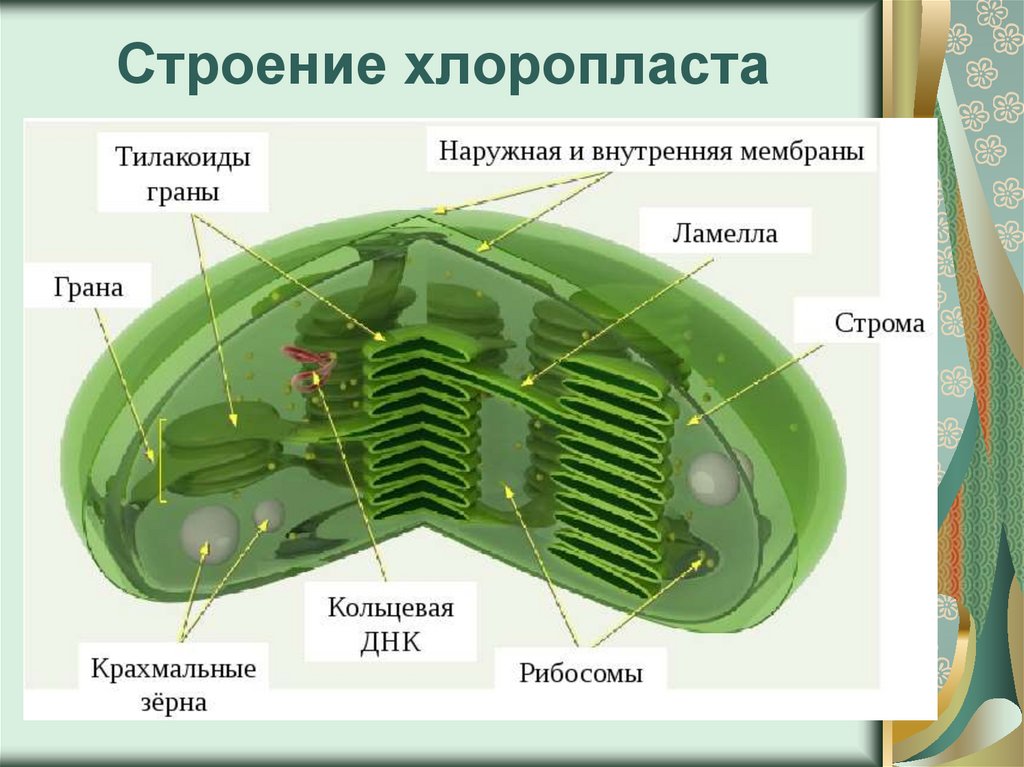
Структура хлоропластов- Хлоропласты высших растений обычно имеют двояковыпуклую или плосковыпуклую форму.

- Хлоропласты можно найти в клетках мезофилла листьев растений.
- У разных растений хлоропласты имеют различную форму: шаровидную, нитевидную, блюдцевидную, дисковидную или яйцевидную.
- Они везикулярные, с бесцветным центром.
- Некоторые хлоропласты имеют булавовидную форму, имеют тонкую среднюю зону, а концы заполнены хлорофиллом.
- У водорослей виден один огромный хлоропласт, который выглядит как сеть, спиральная полоса или звездчатая пластинка.
- Размер хлоропластов также варьируется от вида к виду и является постоянным для данного типа клеток.
- У высших растений средний размер хлоропластов составляет 4-6 мкм в диаметре и 1-3 мкм в толщину.
- Наружная мембрана – Это полупористая мембрана, проницаемая для небольших молекул и ионов, которые легко диффундируют. Наружная мембрана непроницаема для более крупных белков.
- Межмембранное пространство – Обычно это тонкое межмембранное пространство размером около 10-20 нанометров, которое находится между внешней и внутренней мембраной хлоропласта.

- Внутренняя мембрана – Внутренняя мембрана хлоропласта образует границу стромы. Он регулирует прохождение материалов в хлоропласт и из него. Помимо регулирующей активности жирные кислоты, липиды и каротиноиды синтезируются во внутренней мембране хлоропластов.
- Строма- Строма представляет собой щелочную водную жидкость, богатую белком и присутствующую во внутренней мембране хлоропластов. Пространство за пределами тилакоидов называется стромой. ДНК хлоропластов, хлоропластные рибосомы и тилакоидная система, гранулы крахмала и многие белки обнаруживаются плавающими вокруг стромы.
- Система тилакоидов — Система тилакоидов подвешена в строме. Система тилакоидов представляет собой набор мембранных мешочков, называемых тилакоидами. Хлорофилл содержится в тилакоидах и служит средством для протекания процесса световых реакций фотосинтеза. Тилакоиды расположены стопками, известными как граны. Каждая гранула содержит около 10-20 тилакоидов.

- Поглощение световой энергии и преобразование ее в биологическую энергию.
- Производство NAPDh3 и выделение кислорода в процессе фотолиза воды.
- Производство АТФ фотофосфорилированием. НАДФ3 и АТФ являются ассимиляционными силами фотосинтеза. Перенос СО2, полученного из воздуха, на 5-углеродный сахар в потоке во время темновой реакции.
- Расщепление 6-атомного соединения на две молекулы фосфоглицериновой кислоты за счет использования ассимиляционных способностей.
- Преобразование PGA в различные сахара и хранение в виде стрейча. Хлоропласт очень важен, так как он является местом приготовления пищи для всех зеленых растений. Все гетеротрофы также зависят от пластов для этой пищи.
- У растений все клетки участвуют в иммунном ответе растений, поскольку у них отсутствуют специализированные иммунные клетки.
- Хлоропласты с ядром и клеточной мембраной и ЭР являются ключевыми органеллами защиты от патогенов.